comitéProfesionales
Entradas para Profesionales
Captador de la semana: Almería
Desde el comité de Aerobiología Clínica vamos a ir presentando semanalmente todos los captadores que forman parte de la red de captadores de la SEAIC.
Esta semana le toca el turno al Dr. Juan José Zapata Yébenes, conocido alergólogo por ser el presidente del comité de Aerobiología, y que desarrolla su labor asistencial en Almería. El doctor Juan José Zapata siempre ha sido consciente de la importancia del estudio de la aerobiología en cada área de influencia para la comprensión, el diagnóstico y el tratamiento de la polinosis, y es el responsable de la estación aerobiológica de Almería, realizando los contajes en un área geográfica compleja con un alto índice de desertificación.


Acta reunión Noviembre 2024
Nuevos horizontes en la inflamación alérgica para explicar los fenotipos graves de alergia
En las últimas décadas, la prevalencia y la complejidad de las patologías alérgicas han aumentado significativamente. Este incremento se observa no solo en el número de pacientes, sino también en la aparición de casos con perfiles complejos, como los pacientes polisensibilizados, aquellos con remodelado epitelial y quienes muestran una respuesta insuficiente a los tratamientos convencionales. El manejo de estos pacientes representa un desafío para los especialistas en alergología (1).
Entre ellos, un grupo considerable presenta formas graves de alergia. La gravedad no se limita únicamente a aquellos que desarrollan reacciones anafilácticas, que representan un riesgo de vida evidente, sino también a aquellos que experimentan reacciones exacerbadas, como en el caso del asma alérgico grave, caracterizado por su difícil control y alta morbilidad (1). Nuestro grupo de investigación lleva más de una década estudiando los mecanismos subyacentes a estos fenotipos graves de alergia con un doble objetivo: 1) Identificar potenciales dianas terapéuticas para el manejo y control de estos pacientes y 2) la identificación y clasificación de estos pacientes.
Son pacientes que por sus características no responden a la mayoría de los tratamientos disponibles, que no suelen tolerar el tratamiento con AIT, tiene una baja calidad de vida y que, además, al tratarse de pacientes crónicos con muchos años de evolución suponen una importante carga económica para el Sistema Nacional de Salud.
Las características geográficas y climatológicas de nuestro país han permitido el estudio detallado de perfiles graves a lo largo de la geografía española. En Extremadura existe un porcentaje significativo de pacientes con alergia al polen de gramíneas que desarrollan reacciones graves a profilina (2); en Córdoba pacientes con alergia al polen de olivo sensibilizados a alergenos menores como Ole e 7 (3) o en las Islas Canarias, pacientes alérgicos a ácaros que además desarrollan reacciones graves (4) al entrar en contacto con harinas contaminadas con ácaros. Todos estos fenotipos alérgicos comparten características comunes: una respuesta inflamatoria persistente y exacerbada.
La inflamación persistente y no resuelta es un factor subyacente común observado en varias enfermedades humanas aparentemente no relacionadas, incluidas las enfermedades cardiovasculares y neurodegenerativas (5).
Algunos de los mecanismos asociados con la respuesta inflamatoria y que hemos demostrado en pacientes con alergia respiratoria grave son: Metabolismo de Warburg, aumento del metabolismo de los esfingolípidos y lisofosfolipidos, potenciación de las células T efectoras, desregulación de las células T reguladoras y cambios en las características biológicas de las plaquetas (4, 6, 7,8).
Estos hallazgos no solo abren nuevas vías de investigación en el campo de la alergia, facilitando una mejor comprensión de los procesos en estos pacientes, sino que también son relevantes para entender mecanismos subyacentes en otras patologías inflamatorias, como la artritis reumatoide o incluso la esclerosis múltiple, que comparten algunas de estas características inflamatorias. Es por este motivo que en España contamos con la Red de Enfermedades Inflamatorias (REI), financiada por el ISCII, que se dedica a la identificación y traslación de biomarcadores dirigidos a implantar estrategias de medicina personalizada en patologías inflamatorias, incluyendo las alérgicas. Su objetivo es proporcionar nuevas herramientas a los profesional para el tratamiento de estos pacientes y optimizar el uso de recursos de forma efectiva.
- Clin Exp Allergy. 2024 Aug;54(8):550-584. doi: 10.1111/cea.14517.
- J Allergy Clin Immunol. 2019 Feb;143(2):681-690.e1. doi: 10.1016/j.jaci.2018.03.013.
- 2019 Nov;74(11):2261-2265. doi: 10.1111/all.13860
- 2022 Jun;77(6):1772-1785. doi: 10.1111/all.15192
- Nat Rev Immunol . 2021 Nov;21(11):739-751. doi: 10.1038/s41577-021-00538-7
- 2018 Nov;73(11):2137-2149. doi: 10.1111/all.13563.
- 2023 May;78(5):1319-1332. doi: 10.1111/all.15621.
- Int J Mol Sci. 2024 Aug 30;25(17):9425. doi: 10.3390/ijms25179425
TERAPIA INHALADA: INHALADORES DE POLVO SECO
La administración de fármacos por vía inhalatoria contribuye a la mejoría de las personas
con enfermedades en las vías aéreas. Con esta forma de administrar la medicación se
consigue un efecto rápido y eficaz, directamente en el sistema respiratorio.
Los inhaladores contienen en su interior la medicación y a través de una técnica adecuada
de administración se consigue que ésta llegue directamente hasta los pulmones.
Existen dos tipos de inhaladores: presurizados y de polvo seco.
Los inhaladores de polvo seco: a diferencia de los presurizados, no requieren una
sincronización de la inspiración con la liberación de la dosis, puesto que la propia
inspiración activa el depósito. En este tipo de dispositivos el principio activo se encuentra en
forma de polvo.
Como principales ventajas presentan:
– Mayor eficacia que los pMDI convencionales.
– Son de menor tamaño, para manejar con más facilidad y discreción.
– Más fácil la coordinación de pulsación e inhalación.
– No se utilizan gases propelentes contaminantes.
– Muestran las dosis restantes.
– La dosis que se libera en cada dosis es uniforme.
– Lo pueden utilizar pacientes larigectomizados y traqueostomizados.
Como limitaciones tienen las siguientes:
– Precisa una inspiración voluntaria y flujos más altos que los pMDI.
– Tiene mayor impacto orofaríngeo.
– Si no se usa correctamente, se puede perder la dosis preparada.
– Son más caros que los Pmdi.
– No se pueden utilizar en pacientes con ventilación mecánica.
Dentro de los inhaladores de polvo seco, podemos encontrar dos tipos:
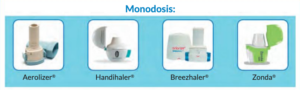
1. Inhaladores de polvo seco monodosis
En este tipo de inhaladores el fármaco se encuentra alojado en forma de polvo seco
en el interior de cápsulas que se guardan en blisters que se dispensan por separado
del dispositivo. Requieren de flujos inspiratorios más elevados que los sistemas
multidosis, por lo que la técnica de inspiración ha de ser más profunda, o si se
precisa se puede hacer dos maniobras de inspiración, para asegurar que se
administra la dosis correcta.
Existen 4 tipos de inhaladores unidosis.
- Aerolizer: De aspecto externo presenta una boquilla tipo chimenea y con un giro lateral se puede acceder a la base. En la base del inhalador dispone de dos pestañas que se han de pulsar simultáneamente para poder perforar la cápsula que conlleva la medicación y liberar la dosis.
- Handihaler: Presenta forma ovoide y consta de 3 piezas unidas por un sistema de bisagra y una tapa que hay que desplazar de forma lateral para colocar la cápsula. Una vez cargada la capsula, hay que volver a encajar la boquilla y pulsar para perforar la capsula y que se libere la medicación con la inhalación. Este inhalador además dispone de una ventana que nos permite comprobar que la cápsula esta bien colocada.
- Breezhaler: Se trata de un dispositivo semejante al aerolizer, con la diferencia de que se la boquilla se abre doblándose sobre el propio dispositivo. Dispone de un tapón protector. Para liberar la dosis hay que pulsar simultáneamente sobre las dos pestañas que tiene en la base.
- Zonda: Presenta un diseño de boquilla que permite que la inhalación sea más sencilla. Dispone de tapa que se abre de forma lateral y esta unida al dispositivo. Además lleva una cápsula transparente que permite comprobar si el paciente ha inhalado correctamente el fármaco
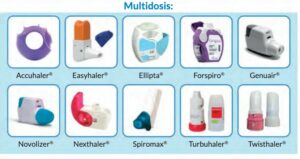
2. Inhaladores de polvo seco multidosis:
- Accuhaler: es un dispositivo con 60 dosis en un blíster enrollado dentro del propio inhalador en forma de disco. Se abre girando la carcasa, y deja al aire una palanca para cargar la dosis y la boquilla a través de la cual se inhala. Al pulsar la palanca, se desliza el obturador de la boquilla y queda al aire la dosis. Tras la inhalación, basta con girar la carcasa en sentido opuesto (no hay que mover la palanca).
- Ellipta: este dispositivo se carga automáticamente al abrirlo. Como ventaja cuenta de contador de dosis que va de 10 en 10.
- Easyhaler: Tiene una carga de 200 dosis, marcando en rojo las últimas 20 dosis. Este dispositivo consta de un depósito, un pulsador, un cilindro dosificador y una boquilla. Además consta de un sistema de seguridad por el cuál ni se puede cargar una dosis con ella cerrado, ni puede cargarse doble dosis. Es el único de este tipo de dispositivos con el que hay que hacer agitado previo.
- Forspiro: El fármaco está en un blíster. Se carga abriendo la boquilla y levantándola, y se carga bajando la boquilla. También tiene contador de dosis, y una ventana por la que se puede ver el blíster y así comprobar que se han realzado las inhalaciones diarias.
- Novolizer: Tiene un depósito de carga de 200 dosis. Se carga cuando presionas un botón de la parte superior. Tiene un indicador que se pone verde o rojo en función de si se ha inspirado correctamente el fármaco. Se puede recargar el cartucho sin tirar el dispositivo cuando se acaba. Tiene una triple comprobación cuando se hace, y es verlo, oírlo y el sabor tras realizarlo(debido a la presencia de lactosa).
- Genuair: el mecanismo es parecido al Novolizer pero con alguna modificación de seguridad como es el de evitar cargar doble dosis y se bloquea cuando está vacío para evitar hacer dosis sin fármaco.
- Nexthaler: Tiene contador de dosis. Se carga la dosis abriendo la tapa. Se trata de un dispositivo más compacto y con partículas extrafinas. Tiene un elemento auditivo, ya que se escucha un click cuando se hace correctamente. Si no se hace la dosis cargada, al cerrar el dispositivo, vuelve al reservorio.
- Spiromax: Tiene contador de dosis y capacidad para 200dosis. Al abrir la tapa, una bomba de aire transfiere el fármaco del depósito a la zona de dosificación. El dispositivo tiene lactosa (que se separa del fármaco por el flujo de inspiración del paciente y aporta sabor).
- Turbuhaler: Tiene contador de dosis y las últimas 20 se marcan en rojo. Se carga girando la rosca, y para ello debe hacerse en un ángulo mayor a 45º de la horizontal. Una vez cargado se puede accionar en cualquier posición al inspirar. La mayoría de sus presentaciones tiene como vehículo la lactosa.
- Twishthaler: Tiene contador de dosis y una forma similar al turbuhaler. Se carga al abrirlo pero debe hacerse en vertical. Se bloquea tras la última dosis.
CALIDAD DE VIDA EN LA ALERGIA A VENENOS DE HIMENÓPTEROS
La calidad de vida de los pacientes con enfermedades alérgicas se suele ver afectada ya que estas patologías generan tanto un impacto social y laboral como gastos directos e indirectos. Actualmente hay múltiples cuestionarios de calidad de vida validados para cada enfermedad en los que se constata el deterioro que causan en la vida de los enfermos que las padecen.
La alergia a venenos de himenópteros genera ansiedad y miedo por el riesgo a sufrir una reacción anafiláctica con un potencial riesgo de desenlace fatal. En Europa las anafilaxias por picaduras de himenópteros suponen el 48,2% de las anafilaxias sufridas en pacientes adultos y el 20,2% de las que padecen los niños. Existen cuestionarios específicos, como por ejemplo el HiCaVi, que valoran la calidad de vida en estos pacientes. El HiCaVi consta de 14 preguntas que valora la afectación de la calidad de vida en diferentes ámbitos en los pacientes mayores de 14 años. Por el momento, este cuestionario no se encuentra validado para pacientes pediátricos ni para apicultores.
Mención especial requieren los pacientes apicultores que sufren reacciones con las picaduras de himenópteros, en los que es considerada enfermedad profesional. En estas personas la calidad de vida se ve aún más mermada ya que influye de forma directa en el ámbito del trabajo y puede tener repercusiones laborales y económicas. Por este motivo, por lo que el HiCaVi no se encuentra validado para los apicultores.
Existen numerosos estudios en los que se valora la modificación de la calidad de vida en pacientes con alergia a himenópteros tras facilitarles autoinyectores de adrenalina y tras administrar inmunoterapia específica. En los pacientes a los que exclusivamente se les daba el autoinyector de adrenalina no se objetivó una mejoría en la calidad de vida a pesar de que la mortalidad por anafilaxia tras picadura desciende de forma importante. Los pacientes suelen percibir dicho tratamiento como molesto ya que hay que llevarlo consigo siempre. Esta percepción negativa favorece la falta de adherencia al mismo. En cambio, en los pacientes en los que se administró inmunoterapia específica, tras solo un año de vacunación el cuestionario de calidad de vida mostró ya una mejoría con respecto al inicial previo. De igual forma, se ha comprobado que en los pacientes en los que se sometieron al tratamiento de inmunoterapia, realizar una repicadura controlada mejoraba los resultados del cuestionario de calidad de vida ya que disminuye el estrés y la ansiedad debidas a la incertidumbre de sufrir una nueva picadura espontánea.
Por lo tanto, podemos ver cómo la alergia a venenos de himenópteros supone una disminución de la vida de los pacientes que la sufren y cómo esta puede mejorar sustancialmente con los tratamientos que existen actualmente para dicha enfermedad, en concreto la inmunoterapia específica.
María Dolores Rodríguez Bote.
Médico Especialista en Alergología. Miembro del comité de alergia a himenópteros.
Referencias:
1. Bemaniyan MH, Heidari M, Tavakol M, Nabavi M, Ramezani Kashal F, Gholami M, et al. A Quality-of-life Study in Patients with Anaphylaxis to Hymenoptera Venom in Iran. Iran J Allergy Asthma Immunol. 11 de febrero de 2024;23(1):59-68.
2. Alfaya T, Vega A, Domínguez-Noche C, Ruiz B, Marqués L, Sánchez-Morillas L. Longitudinal Validation of the Spanish Version of the Health-Related Quality of Life Questionnaire for Hymenoptera Venom Allergy (HRQLHA). J Investig Allergol Clin Immunol. 2015;25(6):426-30.
3. Oude Elberink JNG, van der Heide S, Guyatt GH, Dubois AEJ. Immunotherapy improves health-related quality of life of adult patients with dermal reactions following yellow jacket stings. Clin Exp Allergy J Br Soc Allergy Clin Immunol. junio de 2009;39(6):883-9.
Nuevos horizontes en la alergia a alimentos: el rol de los biológicos
La prevalencia de alergia a alimentos ha ido en aumento en las últimas décadas tanto en España como a nivel global, hasta hace unos años no existía otra recomendación más que la de evitar el alimento al que el paciente es alérgico, lo cual en ocasiones lleva a una dieta muy restrictiva y un empeoramiento en la calidad de vida. Por lo tanto, existe la necesidad de ofrecer nuevos tratamientos más allá de las dietas de evitación.
Una alternativa de tratamiento en auge es la inmunoterapia oral (ITO), la cual consiste en administrar dosis crecientes del alimento al que el paciente es alérgico para aumentar su tolerancia. Esta es generalmente efectiva, pero tiene varias limitaciones como la larga duración del tratamiento durante el cual se pueden presentar reacciones graves y otros efectos adversos, ser específica para cada alimento, no estar estandarizada y no estar disponible en todos los centros ni para todos los alimentos.
Otra alternativa emergente en la alergia a alimentos es el uso de fármacos biológicos. Un fármaco biológico es un medicamento producido a partir de organismos vivos o componentes de estos, como células, tejidos, proteínas o anticuerpos. Estos medicamentos están diseñados para actuar sobre procesos biológicos específicos. Ejemplos comunes incluyen vacunas, hormonas y moduladores inmunitarios. En el campo de la alergología se dirigen contra moléculas concretas de la respuesta inmune de tipo alérgico, es por este motivo que los fármacos biológicos han revolucionado el manejo de enfermedades alérgicas e inflamatorias como el asma, urticaria y la dermatitis atópica, especialmente en casos severos que no responden a terapias convencionales y se muestran prometedores en el tratamiento de alergia alimentaria.
Una aplicación destacada es el uso del biológico Omalizumab, que bloquea la IgE, utilizado desde hace años en asma y urticaria y recientemente aprobado por la FDA para reducir las reacciones alérgicas a alimentos en pacientes con múltiples alergias alimentarias (febrero de 2024), basado en estudios como el OUTMATCH. Aunque no está aprobado específicamente para su uso en combinación con la ITO, múltiples ensayos clínicos han explorado esta combinación con resultados alentadores. Incluso consensos de expertos recomiendan el uso de Omalizumab como adyuvante de la ITO. Esta combinación permitiría aumentar las dosis del alimento en ITO de manera más rápida y segura.
Otro biológico en investigación en alergia alimentaria es el Dupilumab que bloquea ciertas moléculas que participan en la señalización de la respuesta alérgica (IL4 e IL13) y que cuenta ya con eficacia demostrada en múltiples patologías alérgicas como dermatitis atópica, asma grave, poliposis nasosinusal y este mes de noviembre ha sido aprobado por la EMA como el primer y único tratamiento biológico para la esofagitis eosinofílica en pacientes de >1 año de edad. En alergia alimentaria su uso sólo o en combinación con ITO aún está en etapas iniciales de investigación, pero los resultados preliminares son prometedores.
Actualmente están en investigación varios fármacos biológicos dirigidos frente a diferentes moléculas involucradas en la respuesta alérgica y su posible uso en alergia alimentaria, sin embargo, se encuentran todavía en etapas preliminares.
El desarrollo de terapias biológicas ofrece esperanza para muchos pacientes que hasta hace poco no tenían opciones viables pero hace falta más investigación para optimizar su aplicación y establecer guías clínicas claras.
María Carabel Lahera. Clínica Universidad de Navarra (Madrid).
Rosialzira Vera Berrios. Hospital Clínico San Carlos, IdISSC (Madrid).
Bibliografía:
Mutarelli A, Giavina-Bianchi B, Arasi S, Cafarotti A, Fiocchi A. Biologicals in IgE-mediated food allergy. Curr Opin Allergy Clin Immunol. 2023 Jun 1;23(3):205-209. doi: 10.1097/ACI.0000000000000900. Epub 2023 Mar 28. PMID: 37185824.
Sindher SB, Hillier C, Anderson B, Long A, Chinthrajah RS. Treatment of food allergy: Oral immunotherapy, biologics, and beyond. Ann Allergy Asthma Immunol. 2023 Jul;131(1):29-36. doi: 10.1016/j.anai.2023.04.023. Epub 2023 Apr 25. PMID: 37100276; PMCID: PMC10330596.
Sindher SB, Fiocchi A, Zuberbier T, Arasi S, Wood RA, Chinthrajah RS. The Role of Biologics in the Treatment of Food Allergy. J Allergy Clin Immunol Pract. 2024 Mar;12(3):562-568. doi: 10.1016/j.jaip.2023.11.032. Epub 2023 Nov 25. PMID: 38013157; PMCID: PMC11104487.
Wood RA, Chinthrajah RS, Rudman Spergel AK, Babineau DC, Sicherer SH, Kim EH, Shreffler WG, Jones SM, Leung DYM, Vickery BP, Bird JA, Spergel JM, Kulis M, Iqbal A, Kaufman D, Umetsu DT, Ligueros-Saylan M, Uddin A, Fogel RB, Lussier S, Mudd K, Poyser J, MacPhee M, Veri M, Davidson W, Hamrah S, Long A, Togias A; OUtMATCH study team. Protocol design and synopsis: Omalizumab as Monotherapy and as Adjunct Therapy to Multiallergen OIT in Children and Adults with Food Allergy (OUtMATCH). J Allergy Clin Immunol Glob. 2022 Jul 21;1(4):225-232. doi: 10.1016/j.jacig.2022.05.006. PMID: 37779534; PMCID: PMC10509974.
Zuberbier T, Muraro A, Nurmatov U, Arasi S, Stevanovic K, Anagnostou A, Bonaguro R, Chinthrajah S, Lack G, Fiocchi A, Le TM, Turner P, Lozano MA, Angier E, Barni S, Bégin P, Ballmer-Weber B, Cardona V, Bindslev-Jensen C, Cianferoni A, de Jong N, de Silva D, Deschildre A, Galvin AD, Ebisawa M, Fleischer DM, Gerdts J, Giovannini M, Gradman J, Halken S, Arshad SH, Khaleva E, Lau S, Loh R, Mäkelä MJ, Marchisotto MJ, Morandini L, Mortz CG, Nilsson C, Nowak-Wegrzyn A, Podestà M, Poulsen LK, Roberts G, Rodríguez Del Río P, Sampson HA, Sánchez A, Schnadt S, Smith PK, Szajewska H, Mitrevska NT, Toniolo A, Venter C, Warner A, Wong GWK, Wood R, Worm M. GA2LEN ANACARE consensus statement: Potential of omalizumab in food allergy management. Clin Transl Allergy. 2024 Nov;14(11):e70002. doi: 10.1002/clt2.70002. PMID: 39506193; PMCID: PMC11540805.
PICADURAS Y MORDEDURAS DE ANIMALES INVERTEBRADOS TERRESTRES Y MARINOS
Algunos invertebrados frecuentes en nuestro medio pueden producir picaduras o mordeduras en el ser humano, como mecanismo defensivo. Principalmente la ejercen sobre la piel y pueden inyectar diferentes sustancias tóxicas propias de cada uno de ellos. Su identificación es muy importante para poder establecer el tratamiento adecuado y las medidas preventivas de cara a futuras picaduras.
Los animales que con más frecuencia producen este tipo de lesiones son los siguientes:
-Insectos: Himenópteros (avispas, abejas y abejorros), dípteros (moscas y mosquitos) y lepidópteros (orugas).
– Arácnidos: Arañas, escorpiones y garrapatas.
– Quilópodos (ciempiés): Escolopendra.
– Medusas.
– Algunos peces: Rayas.
Vamos a explicar algunas características de los que no son himenópteros.
DÍPTEROS
Las picaduras de mosquitos suelen extraer sangre e inoculan veneno de la saliva. La mayoría de las reacciones son locales y leves y se caracterizan por una pápula de aparición inmediata rodeada de enrojecimiento, que alcanza su máxima intensidad a los 20 minutos. Puede seguir una reacción tardía a las 24-36 horas que desaparece en unos 7-10 días. A veces, algunas de estas reacciones locales pueden ir asociadas a la aparición de vesículas o ampollas. Con mucha frecuencia las picaduras son múltiples. El tratamiento consiste en utilizar lociones contra el picor y antihistamínicos orales. En el caso de viajar a países tropicales es muy importante utilizar repelentes en la ropa. De forma muy excepcional puede haber reacciones generalizadas, que incluyen urticaria y muy raramente anafilaxia. En este último caso sería muy conveniente descartar otras enfermedades relacionadas con la alergia, como es la mastocitosis.
LEPIDÓPTEROS
Las picaduras de orugas suelen ser por contacto directo del insecto o por dispersión en el aire de algunos fragmentos procedentes de los árboles donde se encuentran, como es el caso de la procesionaria del pino (Thaumetopoea pityocampa). Suelen producir reacciones muy pruriginosas en las que luego aparecen lesiones papulosas y enrojecidas por el rascado.
ARAÑAS
El veneno de las mordeduras de arañas tiene componentes que pueden desintegrar a los glóbulos rojos, a determinadas proteínas o afectar al sistema nervioso. La mayoría de las especies distribuidas por España solo suelen causar dolor y molestias locales. Solo la denominada viuda negra (Latrodectus tredecimguttatus) puede producir una toxicidad generalizada del sistema nervioso, con espasmos en niños o ancianos.
ESCORPIONES
El escorpión más común de toda la península ibérica se llama Buthus occitanus. La picadura suele ser en el pie o en las manos al levantar piedras donde se cobijan. Suele haber un intenso dolor local, con un edema progresivo en la zona de la inoculación y alrededor de ella. Los síntomas suelen empezar de forma inmediata y alcanzan su máxima intensidad aproximadamente a las 5 horas. El tratamiento consiste en limpiar la picadura con antisépticos y tratar el dolor con analgésicos. En el caso de dolor muy importante, se debe infiltrar la picadura con anestésicos locales o utilizar opiáceos para controlarlo. Se puede considerar administrar profilaxis antitetánica.
GARRAPATAS
Son arácnidos que se alimentan de sangre. Las reacciones más habituales tras su picadura suelen consistir en dolor local, edema y picor en el punto de anclaje de la garrapata. Si no se extrae correctamente, pueden aparecer cuadros alérgicos de tipo anafiláctico o bien parálisis tóxica, por lo que es muy importante su manejo y retirada. También pueden ser transmisoras de infecciones. Además, la mordedura de garrapata puede generar de forma indirecta alergia a las carnes rojas, a las gelatinas o al medicamento Cetuximab, que se utiliza para tratar algunos tipos de cánceres. Esto se conoce como el síndrome de alergia a alfa-gal y se genera por la semejanza entre algunas proteínas (reactividad cruzada). El alfa-gal es una molécula de tipo oligosacárido que está en los mamíferos no primates y puede producirse una sensibilización a esta a través de la picadura de una garrapata. Con frecuencia, esta reacción incluye anafilaxias tardías tras haber comido carnes de mamíferos o gelatinas o después de haber recibido el Cetuximab.
ESCOLOPENDRAS
Las mordeduras suelen ser venenosas. Las escolopendras se encuentran por todo el mundo, principalmente en climas cálidos. Se les puede encontrar entre la corteza de los árboles o debajo de las piedras, e inyectan el veneno a través de dos colmillos en la zona bucal. Sus mordeduras son muy dolorosas, con dos punciones hemorrágicas, edema e inflamación local y, en ocasiones, con necrosis en el área afectada.
MEDUSAS
Estos invertebrados marinos tienen tentáculos largos donde se encuentran los nematocistos, que son una especie de cápsulas rellenas de veneno dotadas de un filamento en forma de arpón. En una sola picadura se descargan miles de éstos, lo que explica su gran efecto. La mayoría de las medusas solo causan síntomas locales, con dolor y/o ardor intenso en la zona de la picadura seguido de lesiones lineales con la impronta de los tentáculos. En casos más graves aparecen vesículas, equimosis y necrosis cutánea. Las manifestaciones generalizadas incluyen debilidad, náuseas, cefaleas, mialgias, alteraciones cardiacas o pulmonares. Los casos mortales son poco frecuentes. El tratamiento de las reacciones locales leves consiste en evitar la fricción en la zona, eliminar los restos de los tentáculos que puedan quedar adheridos, aclarar con agua salina y sumergir la zona afectada en agua caliente para aliviar el dolor.
RAYAS
Las rayas son un tipo de pez que poseen una cola en forma de látigo. Cuando una persona se adentra en aguas poco profundas y pisa una de ellas, el animal, como mecanismo de defensa, reacciona curvando su cola hacia arriba y hacia adelante, incrustando el aguijón y liberando el veneno. En general, la herida que produce la púa es irregular y sangra abundantemente. El dolor es inmediato e intenso y va disminuyendo gradualmente en un periodo de 6 horas a 2 días. La mayoría de las personas que sufren este tipo de herida manifiestan desvanecimiento, debilidad, náuseas y ansiedad por la intensidad del dolor. El tratamiento consiste en eliminar los residuos si los hay, aclarar con agua salina, inmersión en agua caliente para alivio del dolor, medicación analgésica si precisa y cura de la herida abierta.
Bibliografía: Comité de Alergia a Himenópteros de la SEAIC. Picaduras y mordeduras de invertebrados terrestres (insectos, arañas, garrapatas y ciempiés) y marinos (medusas y peces). En: Alergia a Himenópteros: Recomendaciones y algoritmos de práctica clínica de la Sociedad Española de Alergología e Inmunología Clínica. Actualización. Majadahonda (Madrid): ERGON; 2021. 41-50. ISBN: 978-84-18576-24-9
Jesús Macías Iglesias
Médico Especialista en Alergología
Miembro del Comité de Alergia a Himenópteros y Mastocitosis de la SEAIC
Consejos para un Halloween seguro para personas con alergias alimentarias
La tradición de celebrar Halloween cada 31 de octubre se está popularizando en España, con niños y adultos disfrutando de disfraces y recogiendo dulces. La noche de Halloween es una oportunidad para disfrutar, pero para las personas con alergias alimentarias, tanto niños como adultos, puede suponer un riesgo importante si no se toman precauciones. Las reacciones alérgicas van desde síntomas leves, como picor y vómitos, hasta la anafilaxia, una reacción grave que puede ser mortal Desde el Comité de Alergia Alimentaria de la Sociedad Española de Alergología e Inmunología Clínica (SEAIC), te ofrecemos algunas recomendaciones clave para que esta festividad sea segura y divertida.
1. Opta por actividades alternativas sin comida
En lugar de centrar la celebración en el típico "truco o trato", organiza actividades sin alimentos, como concursos de disfraces, manualidades o juegos. Repartir juguetes pequeños, lápices o calcomanías puede ser una opción divertida y segura para todos los niños.
2. Lee siempre las etiquetas de los productos
Asegúrate de leer con cuidado las etiquetas de los dulces y alimentos que se intercambien. Deshecha aquellos que no tengan una etiqueta clara o los que puedan contener alérgenos comunes como leche, frutos secos o huevo. Considera llevar tus propias golosinas seguras para intercambiarlas y evitar cualquier riesgo.
3. Lleva contigo medicación de rescate
No olvides llevar siempre contigo la medicación indicada por tu alergólogo, incluyendo la adrenalina autoinyectable si es necesaria.
En caso de que tu hijo sea alérgico, y disfrute del día con autonomía, aAsegúrate de que reconoce los síntomas, los comunique bien y si hay algún adulto que los acompañe rápidamente en caso de una reacción.
4. Evita la contaminación cruzada
Si organizas una fiesta, pregunta a los invitados sobre posibles alergias y ofrece opciones aptas para todos. Separa los alimentos seguros de aquellos que puedan contener alérgenos y
usa recipientes bien identificados.
5. Cuidado con los disfraces y el maquillaje
Muchos disfraces y maquillajes de Halloween pueden contener látex, al cual algunas personas alérgicas a alimentos también pueden ser sensibles. Opta por materiales alternativos y evita el uso de máscaras que puedan dificultar la identificación de una reacción alérgica o causar problemas respiratorios.
6. Educación y prevención en el colegio
Si tus hijos celebran Halloween en el colegio, asegúrate de que los profesores y monitores estén informados sobre las alergias alimentarias y sepan cómo actuar en caso de emergencia. Si se van a compartir dulces, es recomendable que lleves opciones seguras identificadas para evitar cualquier incidente.
7. En caso de emergencia, actúa rápido
Comprueba antes de salir que llevas toda la medicación de rescate que tu alergólogo/a te ha recomendado, especialmente la adrenalina autoinyectable.
Ante cualquier síntoma de reacción alérgica, como picor, hinchazón o dificultad para respirar, mantén la calma y sigue las indicaciones de tu especialista: pedir ayuda si estás solo, administrar la medicación, acudir al centro sanitario más próximo o llamar al 112. Si no sabes en ese momento cómo usar el autoinyector de adrenalina, llama al 112 explica la situación y te ayudarán.
Siguiendo estos consejos, puedes disfrutar de una noche de Halloween divertida y segura, evitando sustos relacionados con las alergias alimentarias.
¡Feliz Halloween!
Sofía Carreras Katcheff
¿En qué situaciones debo firmar un consentimiento informado(CI)?
Nosotros, como pacientes, tenemos derecho a ser informados y a preguntar acerca de los procedimientos a los que vamos a ser sometidos.
Según la Ley de Derechos del Usuario de Servicios de Salud (Ley 29414), se debe facilitar CI de manera obligatoria:
• Intervenciones quirúrgicas u otros procedimientos invasivos que conlleven un riesgo para la salud.
• Cuando se realice una exploración, tratamiento o fotografías del paciente con fines docentes.
• Cuando el paciente vaya a participar en estudios de investigación.1
• Si el paciente se negase a recibir o continuar con el tratamiento. EXCEPTO si es una emergencia (en este caso se aplica la doctrina de la presunción del consentimiento) o si pone en riesgo la salud pública. La renuncia al tratamiento se considera legalmente el desenlace natural del proceso de la enfermedad. Si la renuncia al tratamiento pone en riesgo a otras personas o en caso de menores de edad o adultos dependientes, los médicos suelen realizar consultas legales y judiciales, o consultas con personas expertas en cuestiones éticas.2
Cuando el paciente es menor de edad o no puede tomar una decisión de forma consciente será el padre, la madre o el tutor/representante legal quien firme el CI.3
Cada vez es más frecuente el uso de las PDA, Patient Decision Aids, para ayudar al paciente a tomar decisiones. Estas son gráficos, fotografías, vídeos, diagramas o programas interactivos que proporcionan al paciente información necesaria para la toma de decisiones e incluso asesoramiento personal.2
¿En qué situaciones no es necesario la firma de un CI?
• En procedimientos habituales, como pueden ser las extracciones y canalizaciones de vías venosas, el consentimiento está implícito, ya que el paciente acomoda su cuerpo para la realización de tal procedimiento (p. ej., estirar el brazo).
El personal sanitario debe asegurarse como mínimo, que los pacientes comprendan los siguientes puntos:
• Su estado actual y su evolución si rechazase el tratamiento.
• El pronóstico del tratamiento.
• La opinión del profesional médico y la mejor alternativa.
• Que puede formular todas las preguntas que le puedan surgir y éstas ser atendidas por el profesional adecuado.4
EN RESUMEN…
Lo normal es que el CI se pida de forma verbal, exceptuando ciertos casos que será necesario recabarlo por escrito como son:
1. Intervenciones quirúrgicas.
2. Procedimientos diagnósticos y terapéuticos invasivos, presentes en el documento RESCAL (Recomendaciones de Seguridad y Calidad en Alergología).
3. En procedimientos que supongan un riesgo potencial para el paciente o, en caso de mujeres embarazadas, para el feto.
4. Si el paciente va a participar en procedimientos de carácter experimental y proyectos docentes o de investigación.
Bibliografía.
- Consentimiento informado: ¿Qué es y en qué situaciones debe solicitarse? | Conexión ESAN [Internet]. www.esan.edu.pe. Available from: https://www.esan.edu.pe/conexion-esan/consentimiento-informado-que-es-y-en-que-situaciones-debe-solicitarse.
-
Stacey D, Lewis KB, Smith M, Carley M, Volk R, Douglas EE, et al. Decision aids for people facing health treatment or screening decisions. The Cochrane library [Internet]. 2024 Jan 29;2024(1). Available from: https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001431.pub6/full
-
Pope TM. Consentimiento informado [Internet]. Manual MSD versión para público general. Manuales MSD; 2023 [cited 2024 Nov 3]. Available from: https://www.msdmanuals.com/es/hogar/fundamentos/asuntos-legales-y-%C3%A9ticos/consentimiento-informado?ruleredirectid=760
-
Guía de Consentimiento Informado [Internet]. Available from: https://www.saludcastillayleon.es/profesionales/es/bioetica/guias-bioetica-castilla-leon.ficheros/1266525-Guia%20de%20Consentimiento%20Informado.pdf
La dermatitis atópica no sólo afecta a la piel
La dermatitis atópica (DA) es un proceso inflamatorio de la piel caracterizado por un intenso prurito (picor) y piel seca, que presenta una evolución crónica y que cursa en forma de brotes. Es la enfermedad crónica de la piel más común en la infancia, aunque puede iniciarse a cualquier edad. Su desarrollo se debe a interacciones complejas entre la disfunción de la barrera cutánea, alteraciones de la microbiota de la piel e intestinal, desregulación del sistema inmunológico y susceptibilidad genética.
La DA se ha asociado a diferentes enfermedades (comorbilidades) tanto alérgicas como no alérgicas, aunque los mecanismos exactos de estas asociaciones no se conocen por completo. En algunos casos, estas asociaciones podrían ser coincidentes y no una consecuencia directa de la DA.
Recientemente, ha sido publicado un estudio coreano que ha analizado las enfermedades que se asocian a la DA, en más de 67.000 niños con esta enfermedad y que han sido evaluados desde el nacimiento hasta los 15 años de edad. A continuación, detallaremos las comorbilidades encontradas en este estudio 1.
Enfermedades alérgicas:
La DA se asocia con diferentes enfermedades alérgicas como la alergia alimentaria y el asma y rinitis alérgicas, dentro de lo que se conoce como “la marcha atópica”. Este término se refiere a este conjunto de enfermedades alérgicas que, por este orden, se suceden a medida que avanza la edad del paciente. Sin embargo, en algunos casos, esta secuencia no se cumple y las enfermedades alérgicas aparecen de manera independiente y en cualquier etapa de la vida. Posiblemente esto se deba al solapamiento que se produce entre la susceptibilidad genética y los factores ambientales que están involucrados en el desarrollo de las comorbilidades alérgicas.
Enfermedades no alérgicas extracutáneas:
Enfermedades psiquiátricas y neurológicas:
En cuanto a las comorbilidades no alérgicas, las más destacadas son las enfermedades psiquiátricas y neurológicas. Estos autores identifican una asociación entre la DA y la hiperactividad con déficit de atención (TDAH), desórdenes del sueño, alteraciones de la conducta o emocionales, así como con la convulsión febril y las cefaleas. Estas comorbilidades psiquiátricas pueden interrelacionarse, lo que podría jugar un papel importante en la asociación de estas enfermedades con la DA. Por lo tanto, es importante considerar los efectos de las comorbilidades de la DA en las enfermedades psicológicas, pero también el efecto de estas comorbilidades psicológicas en la DA.
Procesos infecciosos cutáneos y extracutáneos:
Los niños con DA presentan infecciones cutáneas más frecuentemente, como cabe esperar al tratarse de una piel alterada. Este estudio también reveló un incremento en las infecciones del tracto respiratorio y gastrointestinal, así como una mayor prevalencia de amigdalectomía. La desregulación inmunológica y la disfunción de la barrera, no sólo a nivel cutáneo sino también en otros órganos, podría contribuir al aumento en el riesgo a infecciones en órganos sistémicos, particularmente en una edad en la que las infecciones son muy comunes. Por otro lado, las infecciones fuera de la piel pueden exacerbar la DA y factores asociados al tratamiento de la DA podrían estar también relacionados con un incremento en el riesgo de infección.
Alteraciones gastrointestinales:
Se identificó una relación entre la DA y alteraciones gastrointestinales como el reflujo esofágico sin esofagitis, el estreñimiento o enfermedades hepáticas. Estas asociaciones podrían deberse a que comparten regulación inmunológica, en el eje intestino-piel a través de la microbiota intestinal, junto con la interrelación con otras comorbilidades de la DA.
Anemia por déficit de hierro:
También se encontró un incremento de la anemia de origen nutricional, posiblemente relacionado con dietas restrictivas injustificadas o a la malabsorción de nutrientes como resultado de la activación inmunológica. El estreñimiento es una comorbilidad de aparición más precoz que la anemia, lo que incrementaría la posibilidad de desarrollarla, dado que el enlentecimiento del tránsito intestinal puede ocasionar pérdida de apetito, dificultar la absorción de nutrientes y aumentar la excreción de hierro. Además, el estreñimiento interrumpe el equilibrio de la microbiota intestinal, afectando al metabolismo nutricional, pudiendo ocasionar también esta pérdida de hierro.
Enfermedades no alérgicas cutáneas:
Además de las comorbilidades fuera de la piel, la DA aumenta el riesgo de enfermedades cutáneas. Las enfermedades autoinmunes, incluyendo el vitíligo, la dermatitis herpetiforme y la psoriasis, comparten fisiopatología en aspectos como la disfunción de la barrera cutánea, la desregulación inmunológica, factores propios del paciente y factores ambientales.
Otros estudios han encontrado asociación entre la DA y la urticaria crónica, que podría explicarse por la desregulación inmunológica, factores genéticos compartidos y el estrés oxidativo.
Riesgo y cronología
El estudio concluye que tanto la edad de aparición como la gravedad de la DA influyen en el número de comorbilidades asociadas. La presencia de comorbilidades fue más frecuente en los niños con un inicio más precoz de la DA, en los varones y en aquellos con dermatitis más grave (medida por un mayor número de ingresos hospitalarios y mayores tasas de prescripción de corticoides tópicos).
La presencia de rinitis y asma alérgicas, principalmente las de inicio en preescolar, se asociaba, en este estudio, a la presencia de varias comorbilidades en el niño mayor y, el asma en concreto, tenía un efecto significativo en las alteraciones psiquiátricas y neurológicas. Sin embargo, la aparición de enfermedades autoinmunes no estaba influida por estas comorbilidades.
En resumen, los niños con DA pueden presentar varias comorbilidades. Reconocerlas a tiempo puede ayudar a mejorar los síntomas y reducir las complicaciones y el impacto tanto de las comorbilidades como de la propia DA.
Dra. Eva María Lasa Luaces. Unidad de Alergología Infantil del Hospital Universitario Donostia. Comité de Alergia Infantil SEAIC.
- Kim JH, Lee E, Ha EK, Shin J, Lee GC, Rha YH, Han MY. Cascade of atopic dermatitis comorbidities in children after birth for 15 years. 2024 Jan;79(1):153-163. doi: 10.1111/all.15917. Epub 2023 Oct 16. PMID: 37843069.
Beneficio coste-efectivo de la inmunoterapia
El ratio de incremento de costo-efectividad (ICER por sus siglas en inglés) se utiliza en la economía de la salud para analizar el coste-efectividad de una intervención en salud en comparación con una alternativa. En el caso de la inmunoterapia específica con alérgenos (ITA), se compararía con el uso de medicación para el control de los síntomas causados por la exposición al alérgeno. Este índice permite evaluar si el coste añadido de un tratamiento está justificado por los beneficios adicionales en la salud que provee.
La efectividad usualmente se mide en resultados de la salud como por ejemplo, la calidad ajustada por año de vida (QALYs, por sus siglas en ingles) o por años de vida ajustados por discapacidad (DALYs); estos cuantifican tanto la calidad como la cantidad de calidad de vida que se gana con una intervención.
El ICER se calcula dividiendo la diferencia en coste de ambos tratamientos entre la diferencia en efectividad entre ambos tratamientos. Un ICER bajo significa que el tratamiento evaluado provee mejores beneficios en salud por un coste adicional menor siendo coste-efectivo; mientras que, un ICER alto sugiere que el nuevo tratamiento es más costoso comparado a los beneficios de salud que provee.
Una revisión sistemática buscando el ICER de la ITA comparada con tratamiento sintomático encontró estudios de alta y media calidad que sugieren que la inmunoterapia específica con alérgenos es coste-efectiva tomando en cuenta el estándar del sistema nacional de salud para el Reino Unido que considera que una intervención es coste-efectiva por debajo de las 20mil libras esterlinas por QALY (1).
De los estudios analizados con alta calidad, demostraba que el uso de GRAZAX o la inmunoterapia especifica con alérgenos con tabletas sublinguales (ITA-SL) en pacientes con rinitis y asma, el ICER para la ITA-SL era de £8816 por QALY en los precios de 2005 (£10 726 por QALY en 2014/15 ajustado por inflación)(2). Otro estudio con ITA-SL demostró que en la población específica de 5-16 años de edad con rinoconjuntivitis con o sin asma, también era costo efectivo con un ICER de £12 168 por QALY con precios de 2008 (un ICER de £13 357 por QALY para precios de 2014/2015)(3).
Uno de los estudios con calidad media, realizado en la población adulta con rinoconjuntivitis tratada con ITA subcitánea (ITA-SC); sugiere que el ICER para la ITA-SC en comparación con medicación sintomática era de £8866/QALY para Austria, £2360/QALY para Dinamarca, £12 486 para Finlandia, £9399 para Alemania, £22 374 para Suecia y £20 691 para Países Bajos actualizados a precios de 2014/2015. (4)
Recientemente, una revisión de la literatura científica hace referencia a nueva evidencia que demuestra que la ITA tanto subcutánea como sublingual en la población pediátrica con alergia a ácaros del polvo y con alergia a gramíneas, ambas, sí son costo-efectivas durante los años evaluados (5).
Otro beneficio del uso de la ITA para mejorar la calidad de vida e incentivar el ahorro a futuro en tus pacientes con alergia a aeroalérgenos.
Bibliografía
- Asaria M, Dhami S, van Ree R, et al. Health economic analysis of allergen immunotherapy for the management of allergic rhinitis, asthma, food allergy and venom allergy: A systematic overview. Allergy. 2018;73(2):269-283. doi:10.1111/all.13254
- Nasser S, Vestenbaek U, Beriot-Mathiot A, Poulsen PB. Cost-effectiveness of specific immunotherapy with Grazax in allergic rhinitis co-existing with asthma. Allergy. 2008;63(12):1624-1629. doi:10.1111/j.1398-9995.2008.01743.x
- Ronaldson S, Taylor M, Bech PG, Shenton R, Bufe A. Economic evaluation of SQ-standardized grass allergy immunotherapy tablet (Grazax(®)) in children. Clinicoecon Outcomes Res. 2014;6:187-196. Published 2014 Apr 8. doi:10.2147/CEOR.S44079
- Keiding H, Jorgensen KP. A cost-effectiveness analysis of immunotherapy with SQ allergen extract for patients with seasonal allergic rhinoconjunctivitis in selected European countries. Curr Med Res Opin. 2007; 23: 1113-1120.
- 5.Rodríguez-Otero N, Ramírez-Mateo E, Plana MN, Heffler E, Antolín-Amérigo D. Cost-effectiveness of allergen immunotherapy. Curr Opin Allergy Clin Immunol. Published online September 18, 2024. doi:10.1097/ACI.0000000000001028
BASES INMUNOLÓGICAS DE LOS FÁRMACOS BIOLÓGICOS EN ASMA GRAVE
- Asma, una patología inflamatoria
El asma es una de las patologías respiratorias más prevalentes en la actualidad. Se caracteriza por un aumento de la reactividad bronquial y, principalmente, por un componente inflamatorio a este mismo nivel. La prevalencia del asma es muy variable entre países, pero se podría considerar que entre el 5 y 10% de la población padece asma. Dentro de esta población existe un cierto número de pacientes que presentan un asma grave no controlada y que según varios estudios podrían suponer entorno al 4-5% de los mismos [1,2]. Para mejorar la respuesta terapéutica de los pacientes que no controlan bien su asma, han aparecido recientemente diferentes tratamientos biológicos que actúan frente a mecanismos fisiopatológicos específicos de la enfermedad.
En los últimos años se ha avanzado mucho en el estudio de la fisiopatología del asma, se ha mejorado de forma exponencial el conocimiento sobre la base inmunológica del asma. La utilización de diferentes técnicas, como las técnicas de imagen radiológicas de alta precisión, la citometría de flujo para estudiar la citología del esputo, o la transcriptómica que ayuda a identificar diferentes fenotipos moleculares, han supuesto un enorme progreso a la hora de plantear el diagnóstico, la clasificación y sobre todo el tratamiento del asma. Todo este conocimiento ha llevado a clasificar inicialmente al asma en fenotipo de inmunidad Th2 alta y de inmunidad Th2 baja (algo que posteriormente se ha modificado por el término T2, debido que las interleuquinas implicadas no son únicamente producidas por linfocitos Th2, sino que también actúan otras células inflamatorias).
El uso de biomarcadores es el siguiente paso, ayudando a clasificar los pacientes en uno u otro grupo. Para esta clasificación utilizamos principalmente los niveles de IgE sérica y el recuento de eosinófilos en sangre (aunque en ocasiones se puede utilizar también el recuento de eosinófilos en esputo). Según estos biomarcadores, pertenecerán al endotipo T2 alto aquellos pacientes con valores de IgE sérica ≥100 UI/L y recuento de eosinófilos en sangre ≥140 eosinófilos/mm3. Del mismo modo, aquellos pacientes que no cumplan alguno de estos 2 criterios se incluirán en el endotipo T2 bajo. Esta clasificación se puede ir ampliando con diferentes subgrupos en función de la edad de comienzo (temprana o tardía), de la patología asociada (atópica o de características intrínsecas), etc…
Finalmente, es importante hacer un repaso de las principales interleuquinas y moléculas inflamatorias relacionadas con la fisiopatología del asma, puesto que éstas son la mayoría de los casos la diana frente a la que actúan los fármacos biológicos. Las más importantes para el manejo del asma en la actualidad son (Tabla 1):
- IL-4: Favorece el cambio de isotipo de células B, favoreciendo el paso de linfocitos Th0 a Th2, lo que deviene en la producción de IL-4, IL-5, IL-9 e IL-13. Participa también en la síntesis de IgE, la regulación de los receptores de IgE, la migración de los eosinófilos hacía el tejido bronquial y alveolar, así como la producción de moco a través de la activación de mastocitos y basófilos. La IL-4 ejerce su efecto por interacción con un receptor de superficie específico presente en los linfocitos T [4].
- IL-5: Fundamental para el desarrollo, activación y migración de los eosinófilos. Se ha observado que ratones en los que existía una deficiencia del gen de la IL-5 hay una respuesta eosinofílica reducida frente a alérgenos [5]. La IL-5 ejerce su efecto por interacción con receptor formado por 2 subunidades: una cadena α exclusiva para la IL-5 y una cadena β común con los receptores de la IL-3 y del GM-CSF [6].
- IL-13: Comparte muchas características estructurales y formales con la IL-4 (con la que tiene una homología del 25%). Debido a ello la IL-4 puede interactuar tanto con su receptor específico como con el receptor de IL-13. Es segregada por linfocitos Th1 y Th2, así como por basófilos y mastocitos, por lo que no es una molécula Th2 específica. Sus acciones se solapan en gran parte con las de IL-4, como por ejemplo el reclutamiento y activación de eosinófilos. Puede relacionarse también con el proceso fibrótico asociado al asma. Finalmente actúa de forma importante en la producción de moco, gracias a la metaplasia de células mucosas caliciformes [7]. El receptor de la IL-13 consta de dos cadenas polipépticas, la IL-4α y la IL-13Rα1.
- IL-17: Promueve la activación de macrófagos y neutrófilos y favorece la liberación de otras citoquinas.
- TSLP: Se trata de una proteína perteneciente al grupo de las llamadas “alarminas” junto con IL-25 e IL-33. Su actividad incrementa la presencia de eosinófilos, los niveles de IgE y la hiperrespuesta bronquial. TSLP ejerce su función por interacción con un complejo de alta afinidad compuesto por el receptor de TSLP y el receptor IL-7 Rα [8].
- Prostaglandina D2: Ayuda al reclutamiento de células Th2 en la vía respiratoria.
| Tabla 1. Moléculas más relevantes implicadas en el proceso inflamatoriodel asma |
| Quimiocinas. Fundamentalmente expresadas por las células epiteliales, son importantes en el reclutamiento de las células inflamatorias en la vía aérea. |
| Cisteinil leucotrienos. Potentes broncoconstrictores liberados por mastocitos y eosinófilos. |
| Citocinas. Dirigen y modifican la respuesta inflamatoria en el asma y determinan su gravedad:
– IL-1 y TNFα: Amplifican la respuesta inflamatoria. – GM-GSF: Prolongan la supervivencia de los eosinófilos en la vía aérea. Citocinas derivadas del epitelio: – IL-33: Promueve las propiedades inflamatorias proalérgicas de las células CD4 y actúa como quimioatrayente de las células Th2. – IL-25: Implicada en la inflamación eosinofílica, en la remodelación y en la hiperreactividad bronquial (esta última más discutida). – TSLP: Induce eosinofilia, aumenta el nivel de IgE, la hiperrespuesta y el remodelado de la vía aérea. – IL-4: importante para la diferenciación de célulasTh2, el aumento de la secreción de moco y la síntesis deIgE. – IL-5: necesaria para la diferenciación y supervivencia de los eosinófilos. – IL-13: importante para la síntesis de la IgE y la metaplasia de las células mucosas. |
| Histamina. Liberada por los mastocitos, contribuye a la broncoconstricción y la respuesta inflamatoria. |
| Óxido nítrico. Potente vasodilatador producido predominantemente en las células epiteliales por la enzima óxido nítrico sintetasa inducible. |
| Prostaglandina D2. Broncoconstrictor derivado fundamentalmente de los mastocitos, está implicada en el reclutamiento de células Th2 en las vías respiratorias. |
| GM-GSF: factor estimulante de colonias de granulocitos y macrófagos, TNF: factor de necrosistumoral. |
Tabla 1: Modificado de GEMA 5.3 [3].
- Fármacos biológicos para el tratamiento del asma grave
En los últimos años han surgido una serie de fármacos que tratan de ayudar a controlar el asma en aquellos pacientes en los que no se consigue de la forma habitual. El tratamiento habitual del paciente asmático va encaminado a conseguir el control de la sintomatología, a prevenir las exacerbaciones y a prevenir la evolución a la obstrucción crónica del flujo aéreo. Este tratamiento se basa principalmente en la utilización de corticoesteroides inhalados (CSI), que puede ir asociada al uso de agonistas adrenérgicos β2 de corta (SABA) o larga duración (LABA). En aquellos pacientes en los que esta medicación no es suficiente (y que podían suponer hasta el 4-5% de los asmáticos, como ya hemos mencionado), solemos encontrar reagudizaciones e ingresos hospitalarios, así como el uso de corticoesteroides orales (CSO), por lo que nos referimos a ellos como pacientes con asma grave no controlada. Es en este grupo de pacientes en los que ha surgido la necesidad de utilizar estos nuevos fármacos biológicos, que van dirigidos frente a mecanismos fisiopatológicos específicos de la enfermedad.
A continuación, procedemos a realizar un breve resumen de los fármacos biológicos disponibles en la actualidad, que incluye sus principales características, tanto clínicas como farmacológicas. Se incluye al final de esta publicación el enlace a las fichas técnicas de todos los fármacos disponibles:
- Omalizumab: Fue el primer fármaco en ser comercializado para el tratamiento del asma grave, en este caso de origen alérgico. Se trata de un anticuerpo monoclonal recombinante (IgG1 kappa) que se une a la IgE libre, impidiendo que ésta se una a los receptores FcεRI de alta afinidad reduciendo así la cantidad de IgE libre e impidiendo que ésta realice su acción sobre las células diana. Su uso está autorizado para pacientes pediátricos con edades de 6 a 12 años, adolescentes y adultos, con valores de IgE en un rango entre 30 y 1500 UI/ml. Es un fármaco que se ha demostrado útil en la reducción de exacerbaciones asmáticas.
- Mepolizumab: Se trata de un fármaco antagonista de IL-5. Mepolizumab se une selectivamente y con elevada especificidad y afinidad a la IL5, impidiendo su unión a la cadena α del receptor de la interleucina 5 (IL-5Rα). De este modo, impide las acciones de la IL-5 sobre el ciclo biológico de los eosinófilos, lo que da lugar a una reducción en su producción y supervivencia. Se trata de un fármaco subcutáneo, cuyo uso está indicado para el tratamiento del asma eosinofílica severa (≥300 eosinófios por μL). Ha demostrado una clara mejoría del número de exacerbaciones y de los síntomas asociados del mismo, así como una leve mejoría del FEV1 y del uso de corticoesteroides.
- Reslizumab: Se trata de un fármaco antagonista de IL-5. Tiene un mecanismo de acción similar al Mepolizumab, difiriendo principalmente en su vía de administración, que en este caso es intavenosa.
- Benralizumab: A diferencia de mepolizumab y del reslizumab, benralizumab es un anticuerpo monoclonal humanizado IgG1 dirigido a la subunidad α del receptor de IL-5. Este receptor se expresa de forma específica en la superficie de eosinófilos y basófilos. Benralizumab es capaz de inhibir la activación de los eosinófilos, produciendo una depleción rápida y casi completa de los mismos por un mecanismo de citotoxicidad mediado por células NK.
- Dupilumab: En este caso, nos encontramos ante un anticuerpo monoclonal IgG4 que inhibe la vía inflamatoria mediante el bloqueo de forma específica de la subunidad α del receptor IL-4R. Como ya hemos mencionado previamente, IL-4R es un receptor sobre el que pueden actuar tanto IL4 como IL 13 y el bloqueo se produce en los receptores de tipo 1 y 2. El receptor tipo 1 se encuentra presente en linfocitos B y T, monocitos, eosinófilos y fibroblastos, mientras que el tipo 2 se encuentra presente en monocitos, fibroblastos, eosinófilos, células epiteliales y células de músculo liso. IL-4 se une a los receptores tipo 1 y 2, mientras que IL-13 se une a los receptores tipo 2. Dupilumab está indicado en el tratamiento del asma grave en niños a partir de 6 años, adolescentes y adultos de endotipo T2, especialmente en aquellos con fenotipo T2 alto. El uso de Dupilumab ha demostrado mejoría respecto al número de exacerbaciones, capacidad pulmonar así como, en menor grado, en el uso de corticoesteroides orales.
- Tezepelumab: El último fármaco que ha sido comercializado para el tratamiento del asma grave. El tezepelumab es un anticuerpo monoclonal (IgG2λ) dirigido contra la linfopoyetina estromal tímica (TSLP) impidiendo su interacción con el receptor heterodimérico de TSLP. El bloqueo de TSLP con tezepelumab reduce un amplio espectro de biomarcadores y citoquinas asociados con la inflamación de las vías respiratorias (p. ej. eosinófilos en sangre, eosinófilos de la submucosa de las vías respiratorias, IgE, FeNO, IL-5 e IL-13); sin embargo, el mecanismo de acción de tezepelumab en asma no se ha establecido definitivamente. Tezepelumab está indicado como tratamiento de mantenimiento adicional en adultos y adolescentes a partir de 12 años con asma grave. Ha demostrado la reducción de exacerbaciones, tanto si se definen como uso de corticoides orales como si precisan atención hospitalaria. También ha demostrado mejorar la función pulmonar y la percepción de la calidad de vida.
El desarrollo de nuevos fármacos biológicos se encuentra ahora en pleno proceso de expansión, por lo que es muy probable que en los próximos años podamos hablar de multitud de nuevos fármacos (algunos de ellos ya en pleno desarrollo). Del mismo modo, el conocimiento cada vez más profundo de la base inmunológica de la patología asmática, hace pensar que nuevas vías y nuevos enfoques de tratamiento se abrirán paso en el futuro. Estaremos atentos a todo ello y lo analizaremos cuando llegue ese momento.
BIBLIOGRAFÍA:
- Quirce S., Plaza V., Picado C., Vennera C., Casafont J. Prevalence of uncontrolled severe persistent asthma in pneumology and allergy hospital unitis in Spain. J Investig Allergol Clin Immunol. 2011;21(6):466–471.
- Domingo Ribas C., Sogo Sagardia A., Prina E., Sicras Mainar A., Sicras Navarro A., Engroba Teijeiro C. Late Breaking Abstract – Prevalence, characterization and costs of severe asthma in Spain (BRAVO 1) Eur Respir J. 2020;56(Suppl 64):4639.
- GEMA 5.3. Guía Española para el Manejo del Asma. 2023. Disponible en: https://www.gemasma.com/
- Izuhara K, Shirakawa T. Signal transduction via interleukin-4 receptor and its correlation with atopy. Int J Mol Med 1999; 3: 3-10.
- Greenfeder S, Umland SP, Cuss FM et al. The role of interleukin-5 in allergic eosinophilic disease. Respir Res 2001; 2: 71-79.
- Tavernier J, Devos R, Cornelis S, Tuypens T, van der Heyden J, Fiers W, Plaetinick G. A human high affinitiy interleukin-5 receptor (IL5R) is composed of an IL5 specific α chain and a β chain shared with the receptor for GM-CSF. Cell 1991; 66: 1175-1184.
- Tomkinson A, Duez C, Cieslewicz G et al. A murine Il-4 receptor antagonist that inhibits IL-4 and IL-13 induced responses prevents antigen induced airways eosinophilia and airway hiprresponsiveness. J Immunol 2001; 166: 5792-5800.
- Bagnasco D, De Ferrari L, Bondi B, Candeliere MG, Mincarini M, Riccio AM, Braido F. Thymic Stromal Lymphopoietin and Tezepelumab in Airway Diseases: From Physiological Role to Target Therapy. Int J Mol Sci. 2024 May 29;25(11):5972.
FICHAS TÉCNICAS:
- Omalizumab: https://cima.aemps.es/cima/dochtml/ft/05319008/FT_05319008.html
- Mepolizumab: https://cima.aemps.es/cima/dochtml/ft/1151043001/FT_1151043001.html
- Reslizumab: https://cima.aemps.es/cima/dochtml/ft/1161125001/FichaTecnica_1161125001.html
- Benralizumab: https://cima.aemps.es/cima/dochtml/ft/1171252001/FT_1171252001.html
- Dupilumab: https://cima.aemps.es/cima/dochtml/ft/1171229006/FT_1171229006.html
- Tezepelumab: https://cima.aemps.es/cima/dochtml/ft/1221677001/FT_1221677001.html
ACTUALIZACIÓN DE LA GUIA DEL PACIENTE CON ANGIOEDEMA HEREDITARIO
Recientemente se ha llevado a cabo la actualización de la Guía del paciente con Angioedema Hereditario, en su 3ª edición. El documento ha sido elaborado en colaboración con la Asociación Española de Angioedema Familiar por Deficiencia de C1 Inhibidor (AEDAF) y miembros del Comité de Angioedema de la SEAIC, así como profesionales de las unidades U754 y U761 de CIBERER y del grupo SHINE de la SEI (Sociedad Española de Inmunología).
La Guía tiene como objetivo fundamental mejorar el conocimiento de la enfermedad para los pacientes afectos y su entorno, aportando información actualizada de forma accesible en formato y lenguaje. Se adjunta enlace a la Guía del Paciente y Tríptico de AEDAF.
Dra. Nieves Prior Gómez , Dr. Jesús Jurado Palomo, Dra. Teresa Caballero Molina. Comité de Angioedema de la SEAIC.
Enterocolitis por Proteínas de la DIETA
La enterocolitis, también conocida como FPIES, aunque de predominio en la infancia no es una entidad tan rara en adultos.
Por este motivo desde el Comité de Alergia a Alimentos os dejamos la siguiente Infografía para vuestra información:
INHALADORES DE CARTUCHO PRESURIZADO O PMDI
La terapia inhalada es fundamental en el abordaje de las enfermedades respiratorias. Es una pieza clave por su comodidad, aplicación selectiva del fármaco en el órgano diana y disponibilidad de dispositivos ligeros y portátiles.
En este caso vamos a abordar el tema de los inhaladores de cartucho presurizado o pMDI.
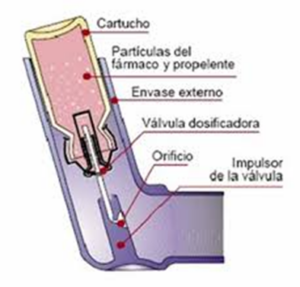
También conocidos como pMDI (Pressurized Metered Dose Inhaler o Inhalador presurizado de dosis Medida) fueron los primeros dispositivos portátiles multidosis utilizados para inhalación de fármacos desde 1956 por Riker Laboratories.
Constan de un cartucho metálico presurizado, una válvula dosificadora, una carcasa externa y una tapa de protección de la boquilla. El cartucho metálico contiene un líquido con un gas propelente donde se encuentra el fármaco disuelto o en suspensión en ese líquido. Lo rodea una carcasa de plástico y se conecta a una válvula dosificadora, de tal forma que, al presionar o activar el dispositivo, el líquido del interior se presuriza en forma de aerosol administrando una dosis fija de fármaco que contiene partículas de diferentes tamaños que salen al exterior a gran velocidad a través de una boquilla.
VENTAJAS E INCONVENIENTES DE LOS INHALADORES DE CARTUCHO PRESURIZADO
TIPOS DE INHALADORES PMDI
1.- Convencionales
- El fármaco está en suspensión o disolución
- Precisan agitar antes de su uso para homogeneizar dosis
- El tamaño de la partícula (DMMA) es entre 1-4 micras
- Tienen mayor impactación orofaríngea y menor depósito pulmonar.
- Se recomienda usar con cámara de inhalación.
- Son los más prescritos.
- Económicos.
- No disponen de contador de dosis.
2.- Partícula extrafina (Modulite® o Alvesco®)
- El fármaco se presenta en solución.
- No necesitan agitar antes de usar.
- El tamaño de partícula (DMMA) es menor de 1,5 micras que garantiza la sedimentación en vías aéreas más distales.
- Tienen menor impactación orofaríngea y mayor depósito pulmonar que los convencionales.
- El efecto freón-frío es menos frecuente.
- Disponen de contador de dosis.
3.- En co-suspensión (Aerosphere®)
- El fármaco se presenta en co-suspensión con partículas porosas de fosfolípidos que los mantienen separados y permite una dosis uniforme.
- Posibilidad de combinación de varios fármacos en el mismo inhalador consiguiendo triple terapia.
- El tamaño de partícula (DMMA) es de 3 micras, de ellas un 25% son partículas extrafinas (<1,5 micra) que garantiza la sedimentación en vías aéreas más distales.
- Tienen un contador de dosis.
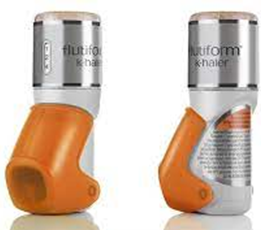
4.- Activados por inspiración o BAI (K-haler®, Autohaler®, Easybreath®).
- No están comercializados en España actualmente.
- Se activan con la inhalación.
- Más simple y fácil de administrar.
- No precisan coordinar la inspiración con la pulsación.
- Tienen menor impactación orofaríngea consiguiendo mayor depósito pulmonar que los convencionales.
- No permiten extraer el cartucho ni usar cámaras de inhalación.
5.- Con sistema JET (Ribujet®)
- Cartucho presurizado con espaciador circular incorporado muy pequeño y sin válvula unidireccional.
- Equivale al uso del inhalador con cámara.
- Al inhalar el fármaco circula en espiral dentro del dispositivo.
- Disminuye el impacto orofaríngeo.
- No precisa coordinar la pulsación con la inhalación.
- Se debe agitar antes.
- En España solo se comercializa Ribujet (budesonida).
6.- Niebla fina o SMI (Respimat®)
- Híbrido entre presurizados y nebulizadores.
- El fármaco está en disolución en un cartucho sin propelentes.
- Se libera en forma de nube fina de aerosol al atravesar un filtro cuando se acciona el dispositivo. Esto reduce el impacto orofaríngeo y consiguen mayor depósito pulmonar.
- Precisan un proceso de carga del cartucho complejo.
- La coordinación pulsación-inspiración es más sencilla.
- No hay que agitar el dispositivo.
- La velocidad de salida del fármaco es más lenta que pMDI.
- Disponen de contador de dosis.
- Puede usarse con cámara.
ERRORES MÁS FRECUENTES
- No realizar una inhalación lenta y profunda (92% de pacientes)
- Falta de coordinación entre la pulsación y la inhalación (54%)
- Cese temprano de la inhalación (24 % efecto freón-frío)
- Inhalación por la nariz (12 %)
- No agitar el envase antes de su uso.
- No retirar la tapa.
- Pulsar más de una vez el dispositivo.
- Ausencia de apnea.
- Sostener el dispositivo al revés.
LIMPIEZA Y MANTENIMIENTO DEL DISPOSITIVO
- Limpiar semanalmente.
- Extraer el cartucho metálico (no sumergir en agua)
- Limpiar la carcasa de plástico y la tapa con paño húmedo o agua templada jabonosa y aclarar con agua.
- En los dispositivos que no se pueda extraer el cartucho, limpiar boquilla con paño seco.
- Debe cebarse el inhalador antes de su uso y si lleva más de 7 días sin usar. Para ello, se realizan dos o tres pulsaciones al aire.
- No exponer a temperaturas altas (>50º), ni congelar ni perforar el cartucho metálico.
BIBLIOGRAFIA
- Sorino C, Negri S, Spanevello A, Visca D, Scichilone N. Inhalation therapy devices for the treatment of obstructive lung diseases: the history of inhalers towards the ideal inhaler. Eur J Intern Med. 2020 May;75:15-18. doi: 10.1016/j.ejim.2020.02.023. Epub 2020 Feb 26. PMID: 32113944.
- Las 4 reglas de la terapia inhalada.
- GEMA inhaladores. Terapia inhalada: fundamentos, dispositivos y aplicaciones prácticas. 2018
- Sellers WFS. Asthma pressurised metered doce inhaler performance: propellant effect studies in delivery systems. Allergy Asthma Clin Immunol.2017; 13: 30.
- Giner J, Plaza V, López-Viña A, Rodrigo G, Neffen H, Casan, P. (2013). Consenso SEPAR-ALAT sobre terapia inhalada. Arch Bronconeumol. 49. 2-14. Disponible en: http://www.archbronconeumol.org/ el 09/07/2013.
HISTORIA DE LOS INHALADORES
La administración o aplicación de los tratamientos inhalados se conoce desde hace 4000 años en China, India y Egipto. En aquella época se administraban plantas ricas en escopolamina y en atropina (como Datura stramonium o Atropa belladona) en forma de vahos, fumigaciones, pipas de agua e incluso “cigarrillos terapéuticos” por su efecto relajante en el músculo bronquial.
La terapia inhalada comienza en los balnearios en el s.XIX cuando empiezan a utilizar las nebulizaciones para tratar la tuberculosis. En 1856, el médico Sales-Girons desarrolló el primer inhalador portátil lo que permitió la administración en domicilio. Aunque estos aparatos tuvieron detractores que los consideraban ineficaces, se siguieron desarrollando nuevos modelos. Si bien, en la farmacología el interés de la vía respiratoria fue en aumento sobre todo cuando se aisló la molécula de adrenalina en 1901 por Thomas Aldrich y Jokichi Takamine y cuando Bullying desarrolló un nebulizador con motor eléctrico. Los siguientes avances se dieron en conseguir broncodilatadores con menos efectos adversos y aparatos más pequeños que generaran partículas inferiores a 5 micras.
De esta forma, gracias a los avances en farmacología se consiguió identificar los receptores α y β adrenérgicos en 1947 y posteriormente, los β1 y β2 lo que dio lugar al descubrimiento en 1969 de un broncodilatador específico con mínimos efectos cardiovasculares y musculares, el salbutamol.
En 1948 se comercializó una primera versión de los futuros dispositivos de inhalación Aerohaler®. Era un vial de vidrio donde se colocaba el principio activo en forma de polvo seco la cantidad que en cada situación se consideraba adecuada y el paciente aspiraba a través de una pieza desmontable, por la boca o por la nariz. Este dispositivo fracasó ya que las dosis administradas eran variables, cada persona utilizaba la dosis que le parecía bien, además los asmáticos que lo utilizaban no eran capaces de generar el flujo suficiente para mover el fármaco y quedaba casi todo en el vial. Cuando se inhalaba por la nariz, la función de filtro de las fosas nasales hacía que no llegara el fármaco hasta el árbol bronquial, por lo que desde entonces se desechó la aplicación nasal.
El primer inhalador de cartucho presurizado surgió en el año 1956, a raíz de la insistencia de la hija asmática del doctor George Maison que le solicitaba un inhalador cómodo y portátil. Éste tenía un mecanismo valvular para dispensación de fluidos por medio de un propelente. Con el tiempo sería empleado en medicina pero también en cosmética (desodorantes, espuma de afeitar, etc) le denominaron Medihaler. Su éxito fue inmediato. Era un aparato ligero, portátil y que siempre administraba dosis fijas que venían medidas de fábrica. Su inicio de acción era rápido y cómodo de usar en cualquier lugar. Su principal desventaja era la coordinación de la inspiración con la activación del aparato.
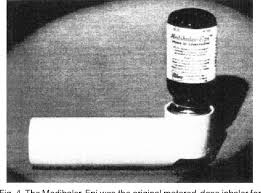
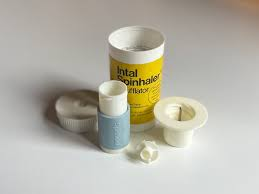
El origen de los inhaladores de polvo seco va unido al descubrimiento, por el médico Roger Altounyan, del cromoglicato disódico como protector del broncoespasmo por su acción relajante sobre el músculo liso. Debido a ello, en 1967 se lanzó al mercado el primer inhalador de polvo seco, Spinhaler® diseñado específicamente para administrar el cromoglicato disódico. Este dispositivo aportó dos grandes avances:a) administración de dosis fijas, por medio de una cápsula que se introducía en el dispositivo y se perforaba para liberar el polvo al inhalar; y b) no se planteaba como una medicación de rescate sino como una “profilaxis”. Spinhaler® ha dado lugar a toda la familia de inhaladores de polvo seco. Y además aportaba la ventaja frente al inhalador de cartucho presurizado de no tener que coordinar la inhalación con la función del aparato. Sus desventajas es que precisan mayor flujo inspiratorio y su uso puede ser complejo en personas mayores o con deformidad en las manos.
En los años 70 llegaron las cámaras espaciadoras/inhalatorias, permitiendo llevar los beneficios del cartucho presurizado a pacientes con dificultad para coordinar la maniobra.
En los años 80 aparecieron los inhaladores de polvo seco multidosis, Diskhaler®. Esto reducía la complejidad y dificultad de la maniobra ya que las cápsulas con el polvo seco vienen integradas en el dispositivo y sólo hace falta cargarlas e inhalar. Aunque siguen precisando de alto flujo inspiratorio por parte del paciente y no se pueden acoplar a una cámara espaciadora al igual que los dispositivos de polvo seco unidosis.
A partir de estas familias de inhaladores, (cartuchos presurizados, inhaladores de polvo seco unidosis y multidosis) han ido surgiendo diferentes sistemas modernos que reutilizan la idea original y añaden mejoras como contadores de dosis, sistemas de feedback para que el paciente realice correctamente la técnica inhalatoria, etc.
Desde 1997 se conocen los inhaladores de vapor suave (Respimat®), en el que el fármaco en disolución es propulsado por un efecto de muelle, sin propelentes. Esto permite una maniobra inhalatoria sencilla, con una capacidad inspiratoria baja o muy baja, que unido a su producción de partículas muy pequeñas alcanza un gran depósito pulmonar. De todas maneras este sistema no llegó a España hasta 2010.
Otras variantes del cartucho presurizado clásico que han aparecido después han sido los sistemas Alvesco® y Modulite® donde el fármaco está disuelto, en vez de en suspensión, produciendo partículas muy finas y permitiendo una penetración pulmonar mayor. A su vez los sistemas accionados por la inspiración, Autohaler®, Easy Breath ® perciben el momento en que el paciente realiza la inspiración y se activan para propulsar el fármaco. Aunque este sistema no se ha comercializado en España.
BIBLIOGRAFÍA
- Las 4 reglas de la terapia inhalada.
- https://www.agefec.org/web/wp-content/uploads/2013/03/INFORMACI%C3%93N-ESCRITA-TALLER.pdf
- GEMA inhaladores. Terapia inhalada: fundamentos, dispositivos y aplicaciones prácticas. 2018
Si soy alérgico al huevo, ¿puedo vacunarme frente a la COVID-19 y la gripe?
Los pacientes alérgicos al huevo y las vacunas cultivadas en embrión de pollo, huevo embrionario o fibroblastos de embrión de pollo que pueden contener trazas de proteína de huevo han sido motivo de preocupación a la hora de aconsejar la vacunación. Mientras que la vacuna del COVID no contiene huevo ni sus proteínas, la vacuna de la gripe sí contiene ovoalbúmina en cantidades residuales (<1mcg/dosis). Aunque en la ficha técnica de la mayoría de vacunas de la gripe aún se contraindica su administración en alérgicos al huevo, las guías médicas ya recomiendan no tomar precauciones especiales para la vacunación contra la gripe en pacientes alérgicos al huevo dado que no se ha demostrado ningún aumento en la notificación de reacciones alérgicas, incluida la anafilaxia, en personas alérgicas al huevo después de vacunarse contra la gripe en comparación con la población general.
La anafilaxia es un evento raro tras la administración de cualquier vacuna. En los casos en los que se ha objetivado una reacción alérgica o anafiláctica tras la administración de la vacuna de la gripe, ésta suele deberse a otros componentes de la vacuna y no al huevo. Por lo que, en caso de que un paciente, independientemente de que sea alérgico o no al huevo, presentase una reacción alérgica o anafiláctica tras la administración de la vacuna de la gripe, debería ser remitido al servicio de Alergología para realizar los estudios competentes que aclaren la causa de esta reacción.
En conclusión, existe suficiente evidencia médica que constata que los pacientes alérgicos al huevo no sólo pueden recibir la vacuna del COVID sino también la vacuna de la gripe de manera segura sin mayor riesgo de sufrir una reacción alérgica que las personas sin alergia al huevo. En caso de sufrir una reacción alérgica con la vacuna de la gripe es cuando estaría indicada la derivación al servicio de Alergología y la toma de precauciones especiales si lo requiriese. No obstante, estas vacunas deben administrarse en un centro de vacunación correctamente equipado bajo la supervisión de personal sanitario.
Soledad Sánchez Sánchez
Especialista en Alergología
Complexo Hospitalario Universitario A Coruña
LAS PLAQUETAS Y SUS VESÍCULAS EXTRACELULARES EN LA INFLAMACIÓN ALÉRGICA
La alergia respiratoria es una enfermedad heterogénea y difícil de tratar, con un fuerte impacto en la calidad de vida del paciente y un elevado coste para los sistemas sanitarios. Estos pacientes suelen sufrir exacerbaciones que llevan a un estado inflamatorio crónico que inducedaños irreversibles en la barrera epitelial.1–4
Los pacientes alérgicos respiratorios especialmente graves representan un reto clínico, ya que en generalno responden a los tratamientos terapéuticos disponibles. Conocer los procesos moleculares y celulares que tienen lugar en estos pacientes podría ayudar a diseñar nuevas intervenciones personalizadasy encontrar biomarcadores para su adecuadaestratificación.
La implicación de células inmunitarias innatas como los basófilos, los mastocitos, los monocitos y los eosinófilosen las enfermedades inflamatorias ha sido ampliamente descrita. Sin embargo, no ha sido hasta hace poco cuando se ha descubierto el papel de las plaquetas dentro del sistema inmunitario innato. En concreto, se han detectado alteraciones plaquetarias en trastornos inflamatorios como la artritis reumatoide, la esclerosis múltiple, la enfermedad de Crohn y la sepsis.5-8
En 2018, Obeso et al. realizaron un análisis multi-ómico con muestras de pacientes alérgicos estratificados por gravedad y encontraron evidencias que apuntaban a la asociación de la inflamación alérgica grave con la alteración de las funciones plaquetarias9. Como células anucleadas, las plaquetas pueden sintetizar un número limitado de proteínas a partir de su ARNm precargadopero la inflamación puede alterar el panorama transcripcional de las plaquetas, como se ha observado en las plaquetas humanas durante la sepsis10.Conjuntamente, la activación plaquetaria se asocia a fuertes cambios metabólicos, especialmente en el metabolismo lipídico11. La señalización lipídica plaquetaria es clave en trastornos inflamatorios como la sepsis. Sin embargo, el contenido lipídico de las plaquetas y su implicación en la inflamación alérgica era un campo inexplorado.
Recientemente, se ha demostrado que las plaquetas son una fuente de mediadores proinflamatorios que diferencian a los pacientes alérgicos graves de los leves y que revelan tanto nuevos mecanismos de regulación inmunitaria como posibles biomarcadores novedosos12.En este estudio, se realizó un fenotipado multi-ómico del plasma rico en plaquetas (PRP) de pacientes alérgicos respiratorios estratificados en graves y leves, y de un grupo de sujetos no alérgicos. Los resultados de la lipidómica mostraron que las plaquetas de pacientes alérgicos graves presentaban niveles elevados de ceramidas, fosfoinositoles, fosfocolinas y esfingomielinas. Por el contrario, mostraban nivelesdismunidos de precursores de eicosanoides. Los resultados de transcriptómica mediante RNAseq confirmaron la sobreexpresión de ARNm de genes relacionados con la activación plaquetaria y el metabolismo del ácido araquidónico en los fenotipos graves. El análisis de las rutas biológicas indicó la alteración de las vías inflamatorias NOD, MAPK, TLR, TNF e IL-17 en el fenotipo grave. Además, las proteínas P-Selectina e IL-17AF estaban aumentadas en el fenotipo grave. Los resultados mostraron que las plaquetas de pacientes alérgicos graves son fuente de lípidos proinflamatorios y presentan marcadores genéticos y proteicos relacionados con una alta activación plaquetaria.
Por otro lado, las plaquetas activadas liberan vesículas extracelulares (EVs) que a diferencia de las plaquetas pueden atravesar las barreras endoteliales y extender su alcance y potencial impacto a otros fluidos y tejidos13. Las EVs son partículas con membrana lipídica con un papel crucial en la comunicación intercelular. Estas partículas transportan proteínas, metabolitos y ácidos nucleicos que son transportados desde la sangre a diferentes tejidos, lo que puede impactar en la respuesta inmunitaria14.
El contenido metabólico de las EVs de plaquetas (PL-EVs) de pacientes con alergia respiratoria grave ha sido recientemente estudiado15. En este trabajo se aislaronPL-EVs de PRP de pacientes con alergia respiratoria grave, leve y de sujetos no alérgicos. Se demostró que las PL-EVs de todos los grupos experimentales eran similares en cuanto a concentración y tamaño de las PL-EVs, y la concentración de proteínas y ARN que contenían. Posteriormente se realizó un análisis metabolómico de su contenido mediante cromatografía de líquidos y cromatografía de gases, ambas acopladas a espectrometría de masas. Los resultados del estudio mostraron que los grupos de PL-EVs que más se diferenciaban entre si eran el de sujetos no alérgicos y el de pacientes alérgicos graves, siendo la mayoría de los metabolitos diferenciales encontrados fosfolípidos y lisofosfolípidos. También se encontraron metabolitos como la L-carnitina, los triglicéridos y una ceramida que estaban disminuidos en las PL-EVs de los pacientes graves a comparación de leves. Estos metabolitos están relacionados con rutas biológicas como transporte de vesículas, señalización celular y respuesta inmune, lo que sugiere que la carga metabólica diferencial de las PL-EVs de los pacientes alérgicos podría tener un papel en la inflamación.
En conjunto, las plaquetas y las PL-EVs de los pacientes alérgicos transportan lípidos y metabolitos específicos según el grado de inflamación de los pacientes alérgicos, lo que abre nuevas vías deinvestigación para caracterizar la progresión de la inflamación alérgica.
Bibliografía
Alergia a las carnes
El valor nutricional de la carne se debe a que está formada por proteínas de alto valor biológico como fuente de aminoácidos esenciales, vitamina B y hierro, muy aprovechables por nuestro organismo.
La alergia a las carnes es una alergia alimentaria poco frecuente en los países desarrollados, a pesar de su elevado consumo. En la infancia, suele asociarse con dermatitis atópica y tiende a desaparecer en los primeros años de vida. No obstante, la alergia a la carne también puede aparecer “de novo” en la edad adulta.
En la actualidad, se desconoce la incidencia general y la prevalencia de la alergia a las carnes en la población general. Entre los pacientes con alergia alimentaria, se ha informado de alergia a la carne en el 3-15% de casos pediátricos y en el 3% de casos adultos.
Su baja prevalencia puede atribuirse, en parte, al hecho de que la mayoría de las carnes se consumen cocidas, y cocinarlas, normalmente aunque no siempre, reduce su alergenicidad.
Las reacciones pueden ser muy variables, desde un cuadro leve de picor en la boca y garganta o algunos habones aislados, pasando por angioedema (inflamación) de labios, párpados… hasta urticaria más extensa, rinoconjuntivitis, asma, síntomas digestivos, y/o cuadros muy graves de anafilaxia.
El tipo de carne que causa la alergia, presenta variabilidad geográfica, en relación con los diferentes hábitos de consumo. En nuestro medio, la alergia a las carnes de mamíferos es más frecuente que la alergia a las aves de corral. De acuerdo con esto, se ha descrito alergia a carne de canguro en Australia y a carne foca y ballena en Alaska.
La alergia a carne de vaca es la más comúnmente reportada, con una prevalencia que oscila entre el 1,5 y el 6,5% entre los niños con dermatitis atópica o con alergia alimentaria. Sin embargo, la alergia a carne de ternera, puede llegar al 20% en niños con alergia a leche de vaca. También se han informado casos de alergia a carne de cerdo, cordero, conejo, pollo y pavo, pudiendo ser alérgico a la carne de una especie o de varias.
- Alergia a carne de vacuno: frecuentemente debida a una proteína (albúmina sérica bovina), que se inactiva con el calor, pudiendo producir reacciones si la carne está cruda o poco cocinada, tolerándose perfectamente cuando la carne está bien cocinada. Se ha demostrado que la homogeneización y liofilización (empleadas en la producción de alimentos para bebés) disminuyen el contenido de albúminas e inmunoglobulinas en la carne, al igual que la digestión con pepsina. Algunos niños con alergia a proteínas de leche de vaca pueden presentar también reacciones con ternera e incluso con otras carnes, pero esto solo ocurre en un pequeño número de casos, generalmente cuando el alérgeno responsable de su alergia es la albúmina sérica bovina.
- Alergia a carne de cerdo: se pueden producir sensibilizaciones primarias a la albúmina sérica y a las inmunoglobulinas por vía inhalada o cutánea, que en primer lugar ocasionan alergia respiratoria y, de forma secundaria, y por reactividad cruzada, reacciones alérgicas tras la ingestión de carne de cerdo poco cocinada. El denominado “síndrome gato-cerdo” es la asociación de alergia respiratoria a gato y alergia alimentaria a la carne de cerdo. Característicamente, estos pacientes pueden no tener síntomas de rinitis al contacto con gatos, ya que la mayoría de los pacientes con síntomas alérgicos a la caspa de gato están sensibilizados a un alérgeno diferente. Se ha descrito también una asociación entre la alergia respiratoria a gato y la carne de cordero o de caballo, y una alergia respiratoria a hámster y alergia a carne de caballo.
- Alergia a carne de cordero: es la más infrecuente aunque, en ocasiones, se asocia a alergia a carne de ternera y cerdo.
- Alergia a carne de pollo: aunque la alergia a huevo es muy frecuente en la infancia, casi todos los niños alérgicos a huevo toleran la carne de pollo. Por otro lado, se han descrito adultos alérgicos a la carne de ave, con tolerancia de huevo y sin alergia a plumas o caspa de ave, cuyos alérgenos responsables, no han sido identificados. Por otra parte existe un síndrome poco frecuente, el “síndrome pescado-pollo”, donde las personas presentan síntomas alérgicos tanto con carne de pollo como pescado y en el que los alérgenos principalmente responsables son las parvalbúminas.
- Síndrome ave-huevo: debido al contacto frecuente con pájaros en el domicilio o en criaderos, hay un grupo minoritario de alérgicos que se sensibilizan por vía inhalada a proteínas de las plumas y/o excrementos de las aves y posteriormente desarrollan alergia al huevo y a la carne de pollo u otras aves (loros, periquitos, canarios, palomas, aves de corral, etc.). Afecta a personas adultas que presentan síntomas con la yema de huevo cruda o poco cocinada, a diferencia de lo que ocurre con la forma de alergia más habitual al huevo que se produce en la infancia y es por sensibilización a proteínas de la clara.
- Síndrome Alfa-gal: en general, las reacciones alérgicas a las carnes suelen ser reacciones de hipersensibilidad inmediata, que ocurren en la primera hora tras la ingesta. En este síndrome, las reacciones tras ingerir carnes de mamíferos (ternera, cerdo, cordero) tienen lugar más tarde de lo habitual, entre 3, 6 y hasta 8 horas después de haberlas ingerido, debido a la unión del alérgeno alfa-gal a los lípidos, que se absorben más lentamente y mediante mecanismos diferentes en comparación con las proteínas. Pueden producirse desde urticarias más o menos extensas hasta cuadros graves de anafilaxia. Estas personas reaccionan a un carbohidrato presente en las carnes de mamíferos no primates llamado galactosa alfa 1-3 galactosa (alfa-gal), al que se han sensibilizado. La sensibilización se ha producido en algún momento, tras la picadura de garrapatas que llevan alfa-gal en su saliva y la inoculan con la picadura. Además de reaccionar a los alimentos, los pacientes sensibilizados a alfa-gal también pueden tener reacciones al anticuerpo monoclonal cetuximab, gelatinas, coloides intravenosos, heparina, válvulas cardiacas de origen bovino o porcino y otros agentes hemostáticos derivados de productos animales.
En la alergia a las carnes, a diferencia de lo que sucede con otros alimentos, se han identificado alérgenos tanto de proteínas como de carbohidratos. Las albúminas séricas y las inmunoglobulinas parecen ser las principales proteínas alergénicas en la carne de ternera y otras carnes de mamíferos (cerdo, cordero, conejo), con una gran homología entre sí, lo que explicaría la alta reactividad cruzada entre carnes de mamíferos. Estas proteínas también podemos encontrarlas en aves como el pollo, aunque con una menor homología con las de los mamíferos, lo que explicaría que los individuos tiendan a reaccionar a carnes de mamíferos o aves pero rara vez a ambas.
El diagnóstico general de alergia a las carnes se realizará en base a la historia clínica y mediante la realización de pruebas cutáneas (prick-test) con extractos de las distintas carnes y la medición en sangre de los niveles de anticuerpos IgE específicos para cada uno de ellos. En ocasiones es necesaria la realización de una prueba cutánea con el alimento en freso (prick-prick) y si hay dudas, también puede ser necesario realizar un test de exposición oral controlada, siempre bajo supervisión del especialista.
En las reacciones con preparados cárnicos, como embutidos o salchichas, habrá que descartar una alergia a algún alimento o compuesto añadido o en el proceso de elaboración, como las proteínas de la leche, el huevo o los hongos.
Ante un diagnóstico confirmado, hoy por hoy, el tratamiento es evitar la ingesta de la carne responsable y los productos elaborados con ella (embutidos, salchichas, gelatinas,…). No obstante, conocer los alérgenos responsables, puede permitir una dieta más flexible, de manera que hay pacientes, cuya alergia depende de las albúminas séricas, que toleran la carne bien cocinada, y otros, presentan síntomas o no dependiendo del grado de cocinado y otro grupo no la tolera de ninguna forma. En algunos casos, se deberán eliminar de la dieta varios tipos de carnes, en cuyo caso, podría ser necesario aportar a la dieta suplementos de hierro y vitamina B.
Dra. Angélica Feliú Vila. Hospital Universitario del Tajo, Madrid. Comité de Alergia Infantil. SEAIC
Bibliografía
- Scott P Commins, MD, PhD. Allergy to meats. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed),Up To Date, Anna M Feldweg, MD. (Accessed on april of 2024).
- Scott H Sicherer, MD, FAAAAI. Food allergens: Clinical aspects of cross-reactivity. In: UpToDate, Robert A Wood, MD (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april of 2024).
- Julie Wang, MD. Component testing for animal-derived food allergies. In: UpToDate, Scott H Sicherer, MD, FAAAAI (Ed), UpToDate, Elizabeth TePas, MD, MS. (Accessed on april 2024).
- García Figueroa, B.E, Mateo Borrega, M.B, 2021. Alergia a las carnes. Zubeldia, J.M, Baeza, M.L, Chivato, T, Jáuregui, I, Senent, C.J. Libro de las enfermedades alérgicas (287-292).
¿En qué consisten las pruebas cutáneas a medicamentos?
Las pruebas cutáneas son útiles para el diagnóstico de la alergia a medicamentos. Existen tres tipos de pruebas cutáneas para el diagnóstico alergológico: prick-test (pruebas intraepidérmicas), pruebas intradérmicas y las pruebas epicutáneas (parches). En el prick test se aplica una gota del medicamento a estudiar en la cara anterior del antebrazo y se hace una ligera punción con una lanceta a través de la gota de dicho medicamento y la capa más externa de la piel conocida como epidermis. De esta forma, se permite que el medicamento penetre y contacte directamente con las células responsables de las reacciones alérgicas, los mastocitos.
Si el paciente presenta un resultado positivo, los mastocitos reaccionan, liberando unas sustancias que producen inflamación, lo que se traduce en la aparición de una roncha o habón, rodeada de un eritema (piel roja). Esta respuesta se inicia en pocos minutos y es máxima a los 15 o 20 minutos y va cediendo a lo largo de las horas.
Si el resultado es negativo, es decir, no se produce la aparición de la roncha, se procede a la prueba cutánea intradérmica. Estas pruebas son más sensibles que las anteriores y consisten en la inyección directa del medicamento en la segunda capa de la piel del paciente (dermis), con una aguja muy fina y se procede a la lectura de forma similar al prick. Está técnica tiene la ventaja de poder investigar la alergia de tipo tardío, que consiste en hacer una lectura a las 24, 48 e incluso 96 horas.
Las pruebas epicutáneas, llamadas también pruebas de parche, consisten en la aplicación sobre la piel, sin punzar, del medicamento sospechoso. Se utilizan generalmente para el diagnóstico de dermatitis de contacto y reacciones tardías, aquellas que aparecen más de 6 horas entre la administración del fármaco y la aparición de la reacción. Se mantiene el alérgeno en la piel, tapado con una tira adhesiva, que se retirará a las 48 horas. La lectura inicial de estas pruebas se realiza a las 48 horas y la respuesta se observa aproximadamente 2 días después de la retirada del parche.
Para realizar las pruebas cutáneas, no se debe de dejar de tomar la medicación habitual. Es importante evitar el tratamiento con antihistamínicos (cetirizina, ebastina, loratadina…) 5-7 días antes de las pruebas y los corticoides orales entre 7 a 21 días antes de las pruebas.
Dra. Giovanna Araujo Sánchez, M.D. PhD.
Servicio de Alergología (ICR).
Hospital Clínic Barcelona. IRCE-IDIBAPS.