comitéProfesionales
Entradas para Profesionales
Beneficios del uso de inmunoterapia en niños
La rinitis alérgica es una condición común caracterizada por síntomas como estornudos, congestión nasal y picazón en los ojos, no es solo una dolencia aislada en los niños. Las investigaciones indican que los niños que padecen rinitis alérgica tienen un mayor riesgo de desarrollar asma a medida que crecen1.
Esta conexión entre las dos condiciones no es coincidencia, ya que tanto la rinitis alérgica como el asma comparten características fisiopatológicas subyacentes. La coexistencia de estas dos enfermedades alérgicas se observa con frecuencia en poblaciones pediátricas1.
Esto subraya la importancia de un diagnóstico temprano y una intervención a tiempo, ya que abordar la rinitis alérgica en sus etapas iniciales puede potencialmente mitigar el riesgo de que un niño desarrolle asma en el futuro1.
Eficacia en rinitis y asma alérgica causada por alergia a ácaros del polvo
La inmunoterapia sublingual ha demostrado ser efectiva en la reducción de exacerbaciones de asma en niños con asma2,3 y menor frecuencia de síntomas diurnos de asma3,4.
Se ha demostrado que la inmunoterapia sublingual con altas dosis de ácaros del polvo fue capaz de reducir la Puntuación Combinada Total de Rinitis (TCRS, por sus siglas en inglés), en niños con rinitis alérgica causada por ácaros del polvo5; esta puntuación es la suma total de puntos que valoran la gravedad de cuatro síntomas: estornudos, mucosidad nasal, congestión nasal, picor nasal.
Además, se consiguió mejorar la puntuación en el Cuestionario de Calidad de Vida de Rinitis (RQLQ, por sus siglas en inglés) en niños con rinitis alérgica causada por ácaros del polvo5. Este cuestionario está diseñado para medir los problemas físicos, emocionales, sociales y en el colegio causados por la rinitis.
La inmunoterapia específica con polen disminuye la probabilidad de tener asma en niños
En un estudio realizado en niños con rinitis alérgica que fueron seguidos durante 3 años, se le administró inmunoterapia para pólenes a un grupo y al otro solamente fueron observados para saber si desarrollaban asma al cabo de los 3 años6.
Estos mismos niños fueron seguidos durante los siguientes 7 años tras el estudio, y se observó que en los niños que recibieron inmunoterapia específica para pólenes, la probabilidad de NO TENER ASMA fueron 4.6 veces más altas en comparación con los niños que no recibieron inmunoterapia para pólenes7.
Referencias
- Farraia M, Paciência I, Castro Mendes F, et al. Allergen immunotherapy for asthma prevention: A systematic review and meta-analysis of randomized and non-randomized controlled studies.Allergy. 2022;77(6):1719-1735. doi:10.1111/all.15295
- Dhami S, Kakourou A, Asamoah F, et al. Allergen immunotherapy for allergic asthma: A systematic review and meta-analysis.Allergy. 2017;72(12):1825-1848. doi:10.1111/all.13208
- Bahçeciler NN, Işik U, Barlan IB, Başaran MM. Efficacy of sublingual immunotherapy in children with asthma and rhinitis: a double-blind, placebo-controlled study.Pediatr Pulmonol. 2001;32(1):49-55. doi:10.1002/ppul.1088
- Niu CK, Chen WY, Huang JL, Lue KH, Wang JY. Efficacy of sublingual immunotherapy with high-dose mite extracts in asthma: a multi-center, double-blind, randomized, and placebo-controlled study in Taiwan.Respir Med. 2006;100(8):1374-1383. doi:10.1016/j.rmed.2005.11.016
- Mosbech H, Canonica GW, Backer V, et al. SQ house dust mite sublingually administered immunotherapy tablet (ALK) improves allergic rhinitis in patients with house dust mite allergic asthma and rhinitis symptoms.Ann Allergy Asthma Immunol. 2015;114(2):134-140. doi:10.1016/j.anai.2014.11.015
- Möller C, Dreborg S, Ferdousi HA, et al. Pollen immunotherapy reduces the development of asthma in children with seasonal rhinoconjunctivitis (the PAT-study).J Allergy Clin Immunol. 2002;109(2):251-256. doi:10.1067/mai.2002.121317
- Jacobsen L, Niggemann B, Dreborg S, et al. Specific immunotherapy has long-term preventive effect of seasonal and perennial asthma: 10-year follow-up on the PAT study.Allergy. 2007;62(8):943-948. doi:10.1111/j.1398-9995.2007.01451.x
EL IMPACTO DE UNA ETIQUETA DE ALERGIA A ANTIBIÓTICOS BETALACTÁMICOS. LA IMPORTANCIA DE UN DIAGNÓSTICO CORRECTO.
El impacto de una etiqueta de alergia a antibióticos betalactámicos es significativo y puede tener consecuencias negativas tanto para la salud del paciente como para el manejo de su tratamiento médico. Los betalactámicos (penicilinas, cefalosporinas, carbapenemas) son los antibióticos más utilizados para tratar diversas infecciones bacterianas. Las penicilinas son también los antibióticos que producen con mayor frecuencia reacciones alérgicas. Sin embargo, la mayoría de los pacientes etiquetados como alérgicos a penicilinas realmente no lo son. En un porcentaje importante de casos, la colocación de una etiqueta de alergia se realiza a partir de cualquier reacción adversa coincidente con la administración del antibiótico, sin haber realizado un estudio alergológico. Si un paciente es etiquetado incorrectamente como alérgico a este tipo de antibióticos, puede conllevar varios problemas asociados:
1. Limitación de opciones terapéuticas: Los antibióticos betalactámicos son una de las opciones más efectivas para tratar infecciones bacterianas. Si un paciente es etiquetado erróneamente como alérgico, los médicos pueden verse limitados en las opciones de tratamiento disponibles, lo que podría resultar en el uso de antibióticos menos efectivos o más costosos.
2. Mayor riesgo de infecciones: El uso de antibióticos alternativos podría no ser tan efectivo en el tratamiento de ciertas infecciones. Esto podría resultar en una mayor duración de la enfermedad, recurrencias de infecciones y un mayor riesgo de complicaciones.
3. Mayor resistencia a antibióticos: El uso inapropiado y excesivo de antibióticos alternativos debido a una etiqueta de alergia falsa podría contribuir al problema global de la resistencia a los antibióticos. Esto sucede cuando las bacterias desarrollan la capacidad de resistir los efectos de los medicamentos, lo que dificulta el tratamiento de infecciones futuras.
4. Costos económicos: El uso de antibióticos alternativos o más avanzados puede ser más caro que el uso de antibióticos betalactámicos estándar. Esto podría aumentar los costes de la atención médica tanto para el paciente como para el sistema de salud a nivel global.
En definitiva, un diagnóstico preciso es esencial para garantizar que los pacientes reciban el tratamiento adecuado y evitar las consecuencias negativas asociadas con una etiqueta de alergia incorrecta. Por ello es fundamental realizar un estudio de alergia tanto para descartar como para confirmar el diagnóstico de alergia a betalactámicos, y en este último caso, ofrecer una alternativa de tratamiento.
Alicia Gallardo Higueras
Hospital Universitario de Salamanca
ENCUESTA SOBRE EL ACCESO A LOS MEDICAMENTOS PARA EL TRATAMIENTO DEL ANGIOEDEMA HEREDITARIO.
El angioedema hereditario (AEH) es una enfermedad rara, con una prevalencia estimada en España de 1,1 a 1,6 afectados por cada 100.000 habitantes. El tratamiento farmacológico se basa en el tratamiento de los episodios agudos (tratamiento a demanda) y la prevención de los ataques, tanto a largo plazo (profilaxis a largo plazo), como la prevención ante situaciones de riesgo (profilaxis a corto plazo), tales como procedimientos médico-quirúrgicos.
Desde la Asociación Española de pacientes con Angioedema Hereditario (AEDAF) se ha llevado a cabo una encuesta a pacientes y a médicos, con el objetivo de analizar si existen diferencias en la disponibilidad y el acceso a los fármacos específicos para la enfermedad con respecto a las guías internacionales vigentes y a los objetivos del tratamiento del AEH. La encuesta se ha podido realizar gracias a una beca concedida a AEDAF por CSL Behring dentro de su programa “2021 Local Empowerment for Advocacy Development (LEAD) Grant For Patient Organisations in the European Union (EU)” y con el patrocinio de CSL Behring España”.
Los resultados se obtuvieron en junio de 2022. Participaron 168 pacientes y 82 médicos que atienden pacientes con AEH, de los cuales 88% eran alergólogos. Se obtuvieron datos sobre el número de ataques y la necesidad de tratamiento en los 6 meses previos y sobre cómo afectaron a las actividades diarias, incluido el trabajo/estudios y el ocio. En cuanto a la disponibilidad de los fármacos, disminuye a medida que se reduce el tamaño del hospital, lo que conlleva una falta de acceso cuando los pacientes no son atendidos en hospitales de mayor complejidad. La creación de los CSUR tiene como objetivo atender a todos los pacientes en igualdad de condiciones, independientemente de su lugar de residencia.
Se observó también que solo un 56% de los pacientes dispone de dos dosis en el domicilio para el tratamiento de los ataques agudos.
Así mismo, un 40% de los centros encuestados no disponen de un programa de entrenamiento para los pacientes en la autoadministración de los fármacos.
Se tiene en cuenta que los datos contemplados en el informe reflejan principalmente la situación de hospitales con mayor experiencia en el abordaje del AEH, sin una gran representatividad de hospitales de menor tamaño, por lo que la disponibilidad real posiblemente sea menor de la observada.
En cuanto a las recomendaciones finales se hace hincapié en:
– La necesidad de instaurar programas de autoadministración de fármacos para tratamiento precoz de los ataques en domicilio, dada su relación directa con un incremento de la calidad de vida de los pacientes.
– Difundir la recomendación de las Guías Clínicas sobre la disponibilidad de dos dosis para el tratamiento de los ataques agudos en el domicilio del paciente.
– Difundir que el objetivo final del tratamiento del AEH según los consensos actuales, es el control total de la enfermedad y normalizar la vida del paciente.
– Difundir los avances logrados en el conocimiento y abordaje de la patología en España gracias a la reciente creación de los CSUR, así como facilitar la derivación a hospitales con mayor experiencia en la atención a pacientes con AEH.
Además de incrementar el conocimiento sobre estos aspectos y las diferencias observadas, los datos pueden ayudar a concienciar a las autoridades sanitarias y a los decisores políticos para que se puedan llevar a cabo las acciones necesarias sobre la normativa estatal y autonómica.
Dra. Nieves Prior
Miembro del Comité de Angioedema
¿Cómo saber si soy alérgico a las picaduras de abejas y avispas?
La alergia al veneno de himenópteros (abejas, avispas, etc.) no es una enfermedad genética o de nacimiento, sino que se puede desarrollar a lo largo de la vida tras haber sufrido picaduras de estos insectos y haberse sensibilizado a ellos. El estudio alergológico está indicado en pacientes que, o bien han sufrido una reacción generalizada con alguna de estas picadura, o que presentan reacciones locales extensas y tienen una alta exposición o mala calidad de vida, con el objetivo de demostrar la presencia de sensibilización específica mediada por IgE frente al veneno del insecto responsable y valorar si son candidatos a recibir una inmunoterapia con alérgenos (vacuna). Por lo tanto, no está indicado el estudio predictivo ni preventivo en pacientes con miedo a las reacciones o con antecedentes familiares de esta alergia.
Para realizar un diagnóstico correcto, se disponen de una serie de procedimientos que explicamos a continuación:
Historia clínica
Es la herramienta fundamental. Los síntomas presentados con la picadura permiten conocer el tipo de reacción sufrida. Es decir, si se trató de una reacción local normal, local extensa, sistémica o incluso si pueden existir otras enfermedades asociadas como los síndromes de activación mastocitaria. Debe recogerse el número y la zona de las picaduras recibidas, el intervalo de tiempo entre la picadura y el inicio de los síntomas y el tratamiento que se administró en ese momento. Otro aspecto muy importante es la identificación del insecto picador. En algunas ocasiones puede parecer más evidente, aunque en otras es posible que sea ambiguo o realmente difícil. El entorno en el que se produce la picadura puede ayudar a ello, sobre todo con respecto al lugar donde sucedió, época del año, comportamiento del insecto, alimentos cercanos, persistencia del aguijón tras la picadura o presencia cercana de nidos o de colmenas. Es posible que esta información pueda sugerir el género del himenóptero, si se trataba de una avispa (Vespula, Dolichovespula, Vespa, Polistes), una abeja (Apis) o un abejorro (Bombus), entre los más habituales. Incluso, en el caso de que se pudiera haber recogido el insecto que picó, se podría aportar el ejemplar en la consulta.
El cuestionario de calidad de vida (HiCaVi), validado por nuestro comité de la SEAIC, permite evaluar este aspecto en este grupo de pacientes y apoyar la indicación de tratamiento con inmunoterapia en algunos casos.
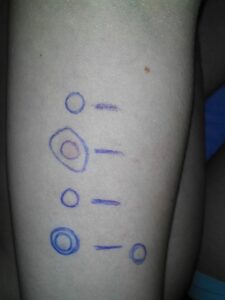
Pruebas cutáneas
Se realizan de dos tipos: Intraepidérmicas o skin prick test, que son similares a las que se hacen en el estudio de pólenes y de otros alérgenos respiratorios ; e intradérmicas, a concentraciones crecientes seriadas. Su positividad es suficiente para demostrar sensibilización.
Pruebas de laboratorio
Mediante una analítica de sangre se pueden medir las IgE específicas frente a venenos completos, que son los anticuerpos que una persona puede generar después de recibir picaduras. Se consideran positivas a partir de 0,1 kUA/L.
El conocido como diagnóstico molecular permite detectar anticuerpos frente a alérgenos concretos para conocer la clase de proteínas que han podido causar la alergia. Es útil en el caso de que varios venenos sean positivos, con el fin de poder diferenciar entre si estamos sensibilizados de forma primaria a uno solo, a varios a la vez (cosensibilización) o si es por el fenómeno de reactividad cruzada (que es la positividad de varios pero por la composición parecida entre ellos).
El uso de otras técnicas de laboratorio más complejas como el CAP-Inhibición o el test de activación de basófilos (TAB) permiten aumentar la precisión y poder llegar a un diagnóstico definitivo.
Además, en todo paciente que haya sufrido una anafilaxia debe solicitarse una triptasa basal, que es una proteasa que puede estar elevada en algunas patologías del sistema inmunitario.
La prueba de exposición mediante repicadura controlada con el propio insecto no está indicada como método diagnóstico por motivos éticos, pero sí es un procedimiento utilizado en pacientes que ya están recibiendo una vacuna y que tiene como objetivo comprobar la eficacia de este tratamiento.
En el caso de pacientes con una historia de una reacción sistémica y un estudio temprano negativo, hay que repetir las pruebas aproximadamente 1-2 meses después, ya que existe un periodo de tiempo en el que pueden darse falsos negativos. Sin embargo, en un 15% de los pacientes con una historia sugerente de alergia no se llega a detectar IgE específica frente a venenos. Igualmente, es importante señalar que los resultados de estas pruebas no se correlacionan con la gravedad de la picadura ni con el riesgo de tener una nueva reacción generalizada posterior.
Finalmente y teniendo en cuenta lo anterior, queda de manifiesto la relevancia de ser valorado por un médico alergólogo, quien brindará a sus pacientes el diagnóstico más preciso y los mejores cuidados.
Jesús Macías Iglesias
Médico Especialista en Alergología
Miembro del Comité de Alergia a Himenópteros y Mastocitosis de la SEAIC
Bibliografía: Comité de Alergia a Himenópteros de la SEAIC. Algoritmo básico: Alergia al veneno de los himenópteros. En: Alergia a Himenópteros: Recomendaciones y algoritmos de práctica clínica de la Sociedad Española de Alergología e Inmunología Clínica. Actualización. Majadahonda (Madrid): ERGON; 2021. 11-21. ISBN: 978-84-18576-24-9
Artículo: El impacto de los inhaladores para el asma en el clima.
Impact of Asthma Inhalers on Global Climate: A Systematic Review of Their Carbon Footprint and Clinical Outcomes in Spain. J Investig Allergol Clin Immunol 2023; Vol 33(4) : 250-262
Resumen
Antecedentes: Los inhaladores presurizados de dosis medidas (pMDI) tienen cierto impacto sobre las emisiones de CO2. Existen alternativas terapéuticas con menor impacto que están siendo ampliamente utilizadas. Sin embargo, la elección del dispositivo y del tratamiento debe considerar las necesidades clínicas y características del paciente.
Objetivo: El objetivo principal fue estimar el impacto de los pMDI, prescritos para cualquier indicación, en las emisiones anuales de CO2 en España. En segundo lugar, evaluamos el impacto potencial del cambio de pMDI a inhaladores de polvo seco (DPI) en pacientes con asma.
Métodos: Se realizó una revisión sistemática de la evidencia publicada entre 2010-2021. Se calculó la media de emisiones anuales de CO2 de DPI y pMDI en dos escenarios: situación actual y una hipotética de cambio de los pMDI por DPI. Se evaluó el posible impacto clínico del cambio.
Resultados: El valor total de CO2-eq/año derivado del uso de DPI y pMDI supone, respectivamente, el 0,0056% y el 0,0909% de las emisiones totales en España. Estos porcentajes serían 0,0076% y 0,0579% substituyendo los pMDI por DPI, excepto la medicación de rescate. La evaluación de la eficacia, manejo, satisfacción, seguridad y utilización de recursos no fue concluyente.
Conclusión: Las emisiones actuales de CO2 derivadas de los pMDI representan un pequeño porcentaje de la huella total de CO2 en España. Es necesario desarrollar nuevos dispositivos más sostenibles y con menor huella de carbono. La idoneidad de los inhaladores y los criterios clínicos de los pacientes (edad o flujo inspiratorio) deben priorizarse en la prescripción.
Artículo completo: https://pubmed.ncbi.nlm.nih.gov/36648318/
¿Qué es la anafilaxia?
En esta primera entrada del blog del Comité de Anafilaxia parece lógico que hablemos acerca de lo que es la anafilaxia.
La anafilaxia es una respuesta inmunológica extrema del sistema inmunitario ante una sustancia alergénica a la que el paciente ha desarrollado alergia.
En esta reacción se libera una gran cantidad de histamina y otras sustancias químicas en el cuerpo, lo que causa una serie de síntomas graves, de instauración rápida y potencialmente mortales, especialmente si no se reconocen los síntomas a tiempo y no se actúa rápidamente.
En este caso la reacción alérgica afecta a todo el organismo, y puede manifestarse con síntomas variados y simultáneos en diversos sistemas; por tanto, sus síntomas pueden variar ampliamente, pero comúnmente incluyen síntomas sugestivos de alergia que afectan a la vez la piel, el aparato respiratorio, el tracto digestivo o sistema cardiovascular.
La afectación de la piel, con urticaria, enrojecimiento, picor o hinchazón, es la manifestación más frecuente en la anafilaxia; está presente en el 80 % de los casos.
La anafilaxia es una emergencia médica que requiere atención inmediata. El tratamiento principal es la inyección precoz de adrenalina intramuscular en el muslo.
Es crucial, una vez tratado el cuadro, identificar y evitar los desencadenantes conocidos de la reacción para prevenir futuros episodios de anafilaxia. El especialista adecuado para ello es alergólogo, a quien debe ser remitido todo paciente que haya presentado una anafilaxia.
Es importante que las personas alérgicas que hayan presentado una anafilaxia y sus familiares estén preparados para actuar en caso de una nueva reacción anafiláctica. Esto implica llevar siempre consigo una inyección de adrenalina y saber cómo administrarla correctamente
La inmunoterapia en “El libro de las Enfermedades Alérgicas”
Información acerca de enfermedades alérgicas de alta calidad y de fácil comprensión
En la página de la Sociedad Española de Alergología (SEAIC) contamos con varias herramientas para los profesionales y también para nuestros pacientes con enfermedades alérgicas y sus familias.
Una herramienta muy útil y actualizada para los que tenemos una consulta privada es “El Libro de las Enfermedades Alérgicas” de la BBVA y la SEAIC, el cual ofrece a nuestros pacientes una lectura interesante que les forma a ellos o a sus familiares mientras esperan a ser atendidos.
Contenido dinámico y moderno
La intención de este libro es informar y ayudar a que las personas entiendan mejor la enfermedad alérgica y sus variados tratamientos. Está escrito con un formato dinámico mediante preguntas y respuestas, recogiendo la mayoría de las preguntas que frecuentemente hacen los pacientes en la consulta de los alergólogos.
Contiene vídeos de pruebas, vídeos del uso de inhaladores, infografías y documentos escritos que se pueden observar o descargar gratuitamente.
La inmunoterapia en El libro de las Enfermedades Alérgicas
La inmunoterapia en “El Libro de las Enfermedades Alérgicas” contiene un capítulo dedicado a la inmunoterapia. En este capítulo aborda dudas frecuentes y soluciona con información actualizada su beneficio, riesgos, recomendaciones, duración, entre otros.
Además, incluye la cartilla de seguimiento para los pacientes con inmunoterapia sublingual y subcutánea que se pueden descargar gratis.
EVOLUCIÓN DE LAS GUÍAS PARA EL MANEJO DEL ANGIOEDEMA HEREDITARIO POR DÉFICIT DE C1-INHIBIDOR
Recientemente se ha publicado en la revista J Investig Allergol Clin Immunol un trabajo realizado por expertos de España y Portugal, que analiza la evolución de las diferentes guías para el tratamiento del Angioedema Hereditario por déficit de C1 inhibidor (AEH-INH-C1).
En este estudio ibérico se han comparado las guías/recomendaciones de tratamiento del AEH-INH-C1 publicadas entre 2010 y 2022, para identificar las principales diferencias en cuanto a los enfoques terapéuticos para el tratamiento a demanda, la profilaxis a corto plazo (PCP) y la profilaxis a largo plazo (PLP).
A nivel mundial, las directrices sobre el AEH evolucionaron con la disponibilidad de nuevos tratamientos y con un cambio en el paradigma de gestión hacia un enfoque individualizado y centrado en el paciente en el que la calidad de vida es fundamental. En consonancia con ello, se observó una tendencia creciente hacia la autoadministración del tratamiento en el domicilio, ya que facilita potencialmente el tratamiento precoz de los ataques, proporciona mayor flexibilidad, comodidad e independencia, y se asocia a una mayor calidad de vida. La PLP es el indicador que más innovaciones ha experimentado a lo largo de los años, paralelamente a la disponibilidad de nuevas terapias y a la toma de conciencia de las necesidades de los pacientes. Se dispone de varias terapias profilácticas con un alto nivel de evidencia, aunque faltan estudios específicos de comparaciones directas entre ellas. Los nuevos tratamientos más eficaces y seguros han ido relegando a los andrógenos atenuados a una segunda línea.
Los objetivos del tratamiento se han ido haciendo más ambiciosos, desde la reducción de la frecuencia, gravedad y duración de los ataques hasta lograr el control total de la enfermedad y la normalización de la vida de los pacientes en la actualidad. Los cambios en la terminología, como la introducción de designaciones como “primera línea” y “segunda línea”, y la introducción de instrumentos de medida de resultados comunicados por los pacientes (“PROM”) para evaluar las percepciones de los pacientes sobre su calidad de vida y bienestar auto experimentados, también son relevantes y se abordan en el documento, junto con las necesidades aún no cubiertas en el tratamiento del AEH-C1-INH.
Branco Ferreira M, Baeza ML, Spínola Santos A, Prieto-García A, Leal R, Alvarez J, Caballero T. Evolution of guidelines for the management of hereditary angioedema due to C1 inhibitor deficiency. J Investig Allergol Clin Immunol. 2023 May 11:0. doi: 10.18176/jiaci.0909. Epub ahead of print. PMID: 37171188.
https://www.jiaci.org/revistas/doi10.18176_jiaci.0909.pdf
Dra. Alicia Prieto García. Servicio de Alergia, Hospital Universitario Gregorio Marañón de Madrid. Comité de Angioedema de la SEAIC.
Durante el verano: ¿Cómo diferenciar una reacción alérgica a un medicamento de una reacción por fototoxicidad?
Con el buen tiempo y las vacaciones de verano, todos pasamos mucho más tiempo al aire libre y aumenta la exposición de nuestra piel al sol, pudiéndose producir algunas reacciones cutáneas no deseadas que conviene diferenciar:
Las erupciones solares o polimorfas ocurren sin relación con la toma de medicamentos, en aquellas zonas de piel que no han recibido sol durante el año. Tienen un aspecto variable, como manchas, granitos, etc… y producen picor, apareciendo a las pocas horas de la exposición en ambas partes del cuerpo (simétricas). Es típico en los primeros días de sol, y algunos pacientes las pueden presentar cada año. Estas reacciones pueden ser evitables utilizando las medidas de fotoprotección adecuadas.
Las reacciones fototóxicas son reacciones de la piel con aspecto de quemadura solar sobre la zona que ha recibido la exposición. Respetan la piel cubierta por ropa, y zonas típicas como el mentón, detrás de las orejas o debajo de la nariz. Se provoca por el uso de algunos productos sobre la piel o medicamentos, como algunos antiinflamatorios, antihipertensivos o antibióticos. Empiezan a los pocos minutos/horas de la exposición solar y se resuelven habitualmente en unos días, dejando en ocasiones marcas durante meses. Aunque no son reacciones alérgicas, son frecuentes, y pueden aparecer en cualquier persona que los utilice, incluso la primera vez que se usa un producto o medicamento a dosis altas.
Las reacciones alérgicas por exposición solar o fotoalergia son reacciones mucho menos frecuentes. Son causadas sobre todo por medicamentos pero también por perfumes, algunos cosméticos e incluso por los protectores solares. Tienen un aspecto de eccema o ampolla, con picor, que afecta a las zonas que han recibido el sol, aunque también puede extenderse a otras zonas con menos intensidad. Aparecen más tarde que las anteriores, a partir de 24-48 horas tras la exposición solar, y mejoran a partir de 5-6 días, sin dejar lesiones residuales. Este tipo de reacciones ocurren en personas con predisposición, que ya han utilizado estos productos previamente sin reacción anterior, y pueden condicionar reacciones cruzadas con otros medicamentos o productos similares.
Si presenta una reacción cutánea, conviene hacer fotografías, y recuerde acudir a su médico de atención primaria para recibir tratamiento, además de contar con el asesoramiento de un Alergólogo para realizar los estudios necesarios.
Bibliografía:
1. Dávila I, Jáuregui, I, Olaguibel, J.M., et al. Tratado de Alergología. 2a Edición. Ergon, 2016.
2. Gruber-Wackernagel A, Byrne SN, Wolf P. Polymorphous light eruption: clinic aspects and pathogenesis. Dermatol Clin. 2014 Jul;32(3):315-34.
3. Montgomery S, Worswick S. Photosensitizing drug reactions. Clin Dermatol. 2022 Jan-Feb;40(1):57-63.
María del Valle Campanón Toro
Hospital Universitario de Burgos
“La quimioterapia puede dar alergia. Los alergólogos podemos ayudar a que los pacientes la vuelvan a tolerar si la necesitan”
La alergia a la quimioterapia, al igual que la alergia a otros medicamentos es una reacción en la cual el sistema inmunológico, que es el responsable de protegernos de agresiones externas, produce una respuesta contra un fármaco empleado para tratar el cáncer. Normalmente, las personas no deberían reaccionar a la quimioterapia, pero en determinadas circunstancias pueden presentar este tipo de respuesta.
Las reacciones alérgicas por estos fármacos generalmente son de 2 tipos:
Las reacciones inmediatas, es decir, aquellas que comienzan rápidamente tras la administración de la quimioterapia. Suelen ser graves, incluso pueden afectar varios órganos simultáneamente, en cuyo caso se trataría de una anafilaxia que es una reacción generalizada que puede poner en peligro la vida. En este tipo de reacciones los síntomas pueden incluir ronchas, picor o enrojecimiento de la piel, hinchazón de cualquier parte del cuerpo, opresión de garganta, afonía, dificultad o pitos al respirar, náuseas, vómitos, dolor abdominal, mareos, dolor de espalda, tiritonas, fiebre o desmayos.
Las reacciones tardías las cuales suelen aparecer una hora después de haber acabado el tratamiento, siendo usual que se presenten tras un tiempo superior a 6 horas. Este tipo no suele ser grave y generalmente causa erupción en la piel, episodios de hinchazón o fiebre.
En cualquier caso, el Alergólogo es el especialista que debe estudiar y confirmar la posible alergia. Si se confirma y el especialista en Oncología recomienda continuar con la misma quimioterapia (porque es la mejor línea de tratamiento para ese cáncer), el alergólogo puede realizar una desensibilización, que en muchos casos es la única forma en la que se puede volver a dar el mismo fármaco en condiciones seguras para evitar una reacción similar o más grave.
La desensibilización es un procedimiento que debe ser realizado en un ambiente hospitalario y bajo supervisión de un alergólogo experto en su ejecución. Consiste en engañar a las células responsables de la alergia (llamadas mastocitos), administrando la quimioterapia de manera gradual y en tiempos muy definidos, para que la persona tolere temporalmente el fármaco sin que desarrolle una nueva reacción alérgica.
La forma en la que se realiza una desensibilización dependerá de la vía por la que se administra habitualmente la quimioterapia, con lo cual puede ser por vía oral, subcutánea o intravenosa entre otras, pero siempre debe ser realizada por un especialista en Alergología.
Un aspecto importante de las desensibilizaciones es que solo tienen un efecto temporal, esto quiere decir, que cada vez que se necesite dar la misma quimioterapia, se deberá realizar una nueva desensibilización.
Recuerde que el Alergólogo es el único especialista formado para ayudarle con estas reacciones.
Dr. Teodorikez Wilfox Jiménez Rodríguez.
Adjunto de la Sección de Alergología.
Coordinador de la Unidad de Desensibilización a Fármacos.
Hospital General Universitario Dr. Balmis, ISABIAL, Alicante, España.
Jimenez_teorod@gva.es
Inmunoterapia con alérgenos
Un tratamiento personalizado
La inmunoterapia con alérgenos o la vacuna de la alergia es el único tratamiento específico porque se prescribe de forma personalizada según el tipo de alergia que tiene el paciente. Este tratamiento tiene la capacidad de modificar las enfermedades alérgicas.
En Alergología, la tolerancia inmunológica se refiere al estado de respuesta inmunológica activa formado por una compleja interacción entre células inmunológicas, tejidos y mediadores. Esta tolerancia inmunológica se alcanza con la inmunoterapia con alérgenos.
Efectos de la inmunoterapia con alérgenos en el sistema inmunológico
La inmunoterapia específica con alérgenos o las vacunas de la alergia, inducen la producción de células T reguladoras que son un grupo especial de linfocitos T CD4+ las cuales se reconocen por su capacidad para suprimir respuestas inmunológicas mediante la producción de citosinas (como la IL-10 y el TGF-b [factor de crecimiento transformador beta]) y de moléculas de superficie inhibidoras (como antígeno 4 del linfocito T citotóxico [CTLA4] y la proteína de muerte celular programada conocida como PD-1).
La inmunoterapia con alérgenos aumenta la actividad de las células T reguladoras. Tras un curso exitoso de tratamiento de inmunoterapia con alérgenos, bajo el estímulo de las células T reguladoras se consigue que las células B disminuyan la producción de IgE y empiecen a producir IgG4 consiguiendo aumentar el umbral de activación al que los mastocitos y basófilos se degranulan siendo este proceso lo que explica la desensibilización temprana que ocurre desde el inicio de la inmunoterapia con alérgenos.
Posteriormente, se ha observado una disminución de mastocitos y eosinófilos infiltrando tejidos específicos y este proceso sucede progresivamente y se conoce como desensibilización tardía; también parte de la tolerancia inmunológica.
En la tolerancia inmunológica, la disminución de la IgE responde a los cambios en las células T de memoria específica y en la disminución de las respuestas de las células B; así como sucede una regulación a la baja de los umbrales de activación de los mastocitos y los basófilos que ocurren como resultado de una exposición a la inmunoterapia específica con alérgenos por vía subcutánea o sublingual, y como resultado final se consigue la supresión de los síntomas alérgicos.
En resumen, la inmunoterapia con alérgenos ofrece los siguientes beneficios:
– Ha demostrado que puede reducir el uso de la medicación porque disminuye los síntomas de la alergia
– Es el único tratamiento que ha demostrado inducir tolerancia alérgeno-específica durante el tratamiento y que se mantiene a largo plazo tras haber suspendido el tratamiento
– Tiene la capacidad de prevenir el desarrollo de nuevas enfermedades alérgicas
¿Qué tipos de reacciones producen las picaduras de abejas y avispas?
Las picaduras de abejas y avispas son relativamente frecuentes. Se estima que entre el 56 al 94% de los adultos han sido picados al menos una vez en su vida. A pesar de estos datos, las reacciones por picaduras que precisan de tratamiento médico son menos frecuentes. Es por este motivo que debemos de poder identificar de forma correcta aquellas reacciones graves o potencialmente graves de aquellos que no lo son y consultar con el Especialista en Alergología cuando la situación lo amerite.
¿Por qué se producen las reacciones por las picaduras de las abejas y las avispas?
El veneno de las abejas y avispas está compuesto por diferentes proteínas y enzimas que al ser inoculadas producen, en la mayoría de personas, una reacción tóxica local no alérgica (reacciones locales). Solo en aquellos individuos que previamente han sido picados y que han formado anticuerpos específicos para el veneno (sensibilizados), la picadura puede desencadenar reacciones posteriores graves (reacciones alérgicas).
¿Qué son las reacciones locales?
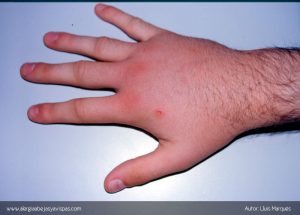
La mayoría de las reacciones locales (RL) se producen como respuesta a los diferentes componentes tóxicos del propio veneno (reacciones no alérgicas). Se caracterizan por picor, dolor e inflamación en el sitio de la picadura. El picor es molesto, el dolor no suele ser muy intenso y el diámetro de la inflamación no supera los 10 cm de diámetro. Son reacciones que desaparecen en menos de 48 horas.
Si el diámetro de la inflamación se extiende por más de 10 cm, abarca más de 2 articulaciones y persiste durante más de 48 horas se le considera una Reacción Local Extensa (RLE). Estas reacciones se deben a un mecanismo alérgico y se presentan en individuos previamente sensibilizados, aquellos que han desarrollado anticuerpos específicos por picaduras previas.
¿Qué son las reacciones sistémicas?
Las Reacciones Sistémicas se presentan solo en personas alérgicas. Se estima que apenas un 2,3 a 2,8% de las picaduras pueden desarrollar una reacción de este tipo. A pesar de ser un porcentaje bajo estas reacciones son potencialmente mortales por lo que merecen toda nuestra atención.
Las Reacciones Sistémicas (RS) se pueden presentar a los pocos minutos tras la picadura. Además de la reacción local en el sitio de la picadura, las Reacciones Sistémicas se caracterizan por la presencia de síntomas que pueden afectar cualquier a órgano desde prurito, urticaria generalizada, malestar general, hasta dificultad para respirar, náusea, vómitos, diarrea, relajación de esfínteres, debilidad, confusión, hipotensión, pérdida de consciencia (Shock Anafiláctico). Debido a la gravedad de esta reacción, la rápida actuación en estos casos puede salvarles la vida a los pacientes.
¿Cómo se tratan las reacciones por picaduras de abejas y avispas?
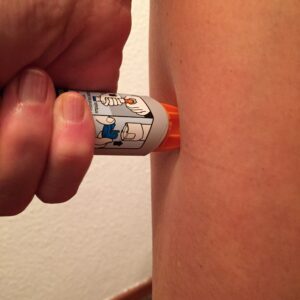
Es muy importante retirar, si lo hubiese, el aguijón. En el caso de las abejas, el saco del veneno unido al aguijón puede continuar inyectando veneno incluso sin la presencia del insecto.
Se recomienda, además, lavar la zona de la picadura, colocar frío local y si el picor es muy molesto se pueden tomar antihistamínicos orales. Si se trata de una reacción local extensa, además de las medidas anteriores es recomendable el uso corticoides. Para las reacciones sistémicas el uso de auto Inyectores de adrenalina es indispensable. Los pacientes alérgicos deben de portar siempre consigo un “kit de emergencia” con al menos 2 auto inyectores de Adrenalina así como el resto de medicación (antihistamínicos y corticoides).
En caso de presentar una reacción local extensa o una reacción sistémica, es imprescindible acudir al alergólogo para que estudie el caso y vea si es subsidiario de recibir vacuna frente al insecto responsable de la reacción. Este tratamiento es el único capaz de evitar reacciones posteriores.
Federico de la Roca Pinzón
Especialista en Alergología
Miembro Comité Himenópteros de SEAIC
¿Qué hace una enfermera en un Servicio de Alergia?
Las enfermeras somos los profesionales que cuidan de las personas. En las consultas de alergia
tenemos un papel destacado e importante.
Cuando acudes a la consulta de alergia es porque has padecido signos o síntomas como tos,
falta de aire, picor de ojos, congestión nasal, problemas en la piel… que a tu médico de
atención primaria le han hecho pensar que tienes un problema de alergia relacionado con el
polen, ácaros del polvo, hongos, epitelio de animales. También acudes si has tenido alguna
reacción con algún alimento, medicamento o si te ha “picado” algún insecto y te has
encontrado mal. Frente a este tipo de reacciones siempre se debe de realizar un correcto
diagnóstico, con el objetivo de encontrar una respuesta adecuada a cada dolencia.
En este proceso diagnóstico, en los Servicios de Alergia, las enfermeras desempeñamos
funciones asistenciales (realizando pruebas diagnósticas – educación para la salud), docentes
(formando en aquellos aspectos relevantes de la patología alérgica), realizando en ocasiones la
gestión para una buena organización de tu asistencia sanitaria o de los recursos materiales que
se precisan, así como funciones de investigación para encaminar los mejores cuidados que hay
que prestar al paciente alérgico con rigor científico.
Las enfermeras de alergia, realizamos una atención integral del paciente cuando llega a
nuestro servicio (al niño, adulto o a la persona mayor) y somos las responsables de la
realización de las pruebas necesarias, indicadas por el alergólogo, para poder llegar a un
diagnóstico preciso.
La enfermera revisa la historia clínica y procede según el protocolo de cada unidad. A partir de
ese momento, se inicia un proceso de acompañamiento, administrando todos los cuidados que
se precise según protocolos establecidos para cada actuación.
Las enfermeras de alergia participamos activamente en trasmitir los conocimientos necesarios
en forma de educación sanitaria para que las personas que han sido diagnosticadas de algún
tipo de alergia, o patología respiratoria como la rinitis y/o el asma, puedan autocuidarse con
seguridad mejorando de este modo su calidad de vida.
Con este blog pretendemos daros a conocer para qué realizamos distintas pruebas
diagnósticas y como tenéis que prepararos para ellas; también hablaremos de la
Inmunoterapia (coloquialmente vacunas), de los autocuidados del asma, autocuidados de
anafilaxia, autocuidados de la piel y también os explicaremos medidas preventivas de las
diferentes enfermedades relacionadas con la Alergia.
Si necesitas saber más sobre tu enfermedad alérgica, tu tratamiento, las pruebas hasta llegar a
su diagnóstico o un mejor estilo de vida, no dudes en preguntar a la enfermera del servicio de
alergia que te corresponda….y leer este blog.
Alergia a Prunáceas
En Verano aumenta el consumo de futas de la familia de las prunáceas, que son aquellas que tienen un hueso que contiene en su interior una especie de almendra, como el melocotón, albaricoque, cereza, ciruela, paraguayo o nectarina. Se consideran responsables del 70 % de todas las reacciones alérgicas a las frutas.
Algunos tips importantes a tener en cuenta son:
- En el área mediterránea predomina la alergia a vegetales por sensibilización a LTP (proteínas transportadoras de lípidos), muy presentes en las prunáceas, especialmente en la piel, donde su concentración es mucho mayor.
- La LTP es un alérgeno muy estable que condiciona que su alergia se produzca con la ingesta de la fruta fresca al igual que procesada (zumos, mermeladas, compotas…)
- Conocer el alérgeno vegetal responsable de la alergia permite predecir la gravedad de las manifestaciones clínicas que puede desencadenar y la posible reactividad cruzada con otros alimentos. La alergia a LTP se puede asociar con alergia a otros alimentos como frutos secos y otras frutas rosáceas (manzana, fresa…)
- Especialmente en el caso de alergia a LTP, algunos factores como el ejercicio físico, el alcohol o los antiinflamatorios (AINE) pueden actuar como cofactores, y desencadenar o amplificar una reacción.
- La alergia a prunáceas en nuestro país, aunque con menor frecuencia, también se puede producir relacionada con la alergia al polen y en este caso, en muchos pacientes, es posible consumir la fruta cocinada. Es aconsejable por tanto, seguir las indicaciones de su alergólogo sobre la evitación o los permisos en las formas de consumo.
La reacción alérgica a las prunáceas como el melocotón se suele producir después de su ingesta y, con menor frecuencia, tras su inhalación o tras el contacto cutáneo. Cuando provoca síntomas, suelen aparecer en la primera hora, habitualmente a los pocos minutos. Los síntomas que puede desencadenar incluyen:
- Síndrome de alergia oral (SAO). Síntomas locales leves, que consisten en picor oral, orofaríngeo y/o ótico. Son los más frecuentes
- Síntomas cutáneos. Síntomas locales en la zona de contacto con el alimento, o generalizados en forma de urticaria y angioedema (hinchazón) de labios, párpados, lengua u otras zonas.
- Síntomas digestivos. Náuseas, vómitos, dolor abdominal, distensión abdominal, diarrea
- Anafilaxia. Reacción alérgica grave de instauración rápida y de riesgo para la vida. Puede iniciarse con picor oral, faríngeo, en manos, pies o cuero cabelludo y después progresar con generalización del picor y aparición de urticaria y/o angioedema, así como síntomas generales respiratorios, digestivos y cardiovasculares (conjuntivitis, obstrucción nasal, estornudos, mucosidad, dificultad para tragar o respirar, tos, silbidos, náuseas, vómitos, dolor abdominal, diarrea, y caída de la tensión arterial con mareo, pérdida de conocimiento, y si la situación se prolonga sin tratamiento, parada cardiorrespiratoria). Se requiere, pues, tratamiento médico urgente en el momento del episodio. En cuanto el paciente advierte la generalización de la reacción, debe administrarse la adrenalina autoinyectable y ser llevado a un centro médico.
Es importante un buen diagnóstico para evitar los alimentos con los que el paciente presente síntomas. Así mismo, siempre llevar consigo la medicación de rescate como antihistamínicos, corticoides y por supuesto la adrenalina autoinyectable.
Video: ¿cómo se cuentan los pólenes?
Muchas personas sufrimos enfermedades respiratorias alérgicas causadas por pólenes, y durante los meses de primavera buscamos información sobre cómo de alto está ese día el polen que nos preocupa, de cara a protegernos, tomar medicación o planificar un viaje, pero, ¿cómo se realizan esos contajes?
El comité de Aerobiología cuenta con una red de colectores repartidos por todo el país, con el objetivo de potenciar el estudio de los pólenes y hongos ambientales. Se trata de captadores volumétricos que succionan el aire ambiente, impactando las partículas sobre una superficie que posteriormente se recoge, se prepara sobre un portaobjetos, y finalmente se realiza un contaje de manera manual utilizando un microscopio óptico.
Aquí un video publicado por Canal Sur el 26 de abril de 2023 en el que Manuel Alcántara, vocal de la Sociedad Española de Alergología e Inmunología Clínica, explica y muestra el proceso.
Dra. Alicia López Guerrero, Hospital Universitario de Jaén, Jaén. Comité Aerobiología Clínica.
Microbiota y alergia alimentaria – una nueva herramienta para su tratamiento
Lo primero, ¿Qué es eso de la microbiota intestinal?
La microbiota intestinal se define como la comunidad de microorganismos que habita en nuestro tracto digestivo. Esta comunidad está formada por una gran variedad de bacterias, hongos, virus y otros microorganismos que desempeñan un papel fundamental en la salud humana.
La composición de la microbiota intestinal depende de factores como la genética, la dieta, el modo de nacimiento, el tipo de lactancia y la toma de antibióticos entre otros, sobre todo en los tres primeros años de vida, que es cuando se establece la composición de nuestra microbiota intestinal que tiende a persistir en la vida adulta.
Nuestro estilo de vida urbano e industrializado nos expone a una menor diversidad microbiana y hace que esa exposición microbiana sea frente a una serie ¿concreta? O ¿microorganismos específicos? de microorganismos, lo que se traduce en una menor diversidad de nuestra microbiota intestinal y el desarrollo de una microbiota intestinal ¿específica? concreta que a su vez se ha relacionado con un mayor riesgo de desarrollar una patología alérgica en general y alergia alimentaria en concreto.
En los últimos años, se ha demostrado que la microbiota intestinal juega un papel importante en la alergia alimentaria, lo que hace plantearnos si este papel podría aprovecharse a nuestro favor para prevenir e incluso llegar a tratar la alergia alimentaria.
Pero… ¿y qué es exactamente la alergia alimentaria?
La alergia alimentaria es una reacción exagerada e inapropiada del sistema inmunológico ante la proteína de un alimento específico. Puede producir diferentes síntomas desde los más leves (ej. picor en la boca) hasta las reacciones más graves potencialmente mortales llamadas anafilaxias.
¿Qué relación existe entre la microbiota intestinal y la alergia alimentaria?
Entre las funciones de la microbiota intestinal se encuentra el desarrollo y mantenimiento de un sistema inmunológico saludable.
Cuando se produce la introducción de la alimentación complementaria en los lactantes, la microbiota intestinal juega un papel fundamental en el desarrollo de tolerancia oral a los alimentos. Se trata de un momento crucial en el que una microbiota intestinal alterada puede contribuir a la aparición y desarrollo de la alergia alimentaria. A continuación, resumimos los hallazgos más relevantes obtenidos en estudios observacionales y preclínicos que apuntan al papel de la microbiota intestinal en el desarrollo de alergia alimentaria:
- Determinadas exposiciones microbianas en la primera infancia se asocian a menor o mayor riesgo de desarrollar alergia alimentaria. Así, tener hermanos mayores o perro en domicilio durante el primer año de vida se asocia a un menor riesgo de desarrollar alergia a huevo al año de edad, mientras que nacer mediante cesárea se asocia a un mayor riesgo de tener alergia alimentaria.
- La composición de la microbiota intestinal en los primeros meses de vida, se asocia a riesgo de desarrollar sensibilización alimentaria (el paso previo a una posible alergia alimentaria) en los primeros años de vida.
- La composición de la microbiota intestinal de niños con alergia alimentaria es distinta a la de niños sin alergia alimentaria.
- En niños con alergia alimentaria, la composición de su microbiota intestinal en los primeros meses de vida podría estar asociada a la adquisición de tolerancia espontánea en los siguientes años.
- Modelos murinos han demostrado que: (i) la microbiota intestinal tiene un papel supresor y evita la sensibilización y el desarrollo de alergia alimentaria y que (ii) la susceptibilidad de tener alergia alimentaria se transmite a través de la microbiota fecal.
Los conocimientos adquiridos en estos estudios han sentado las bases para llevar a cabo ensayos clínicos en humanos en los que se emplean probióticos, prebióticos y simbióticos con el fin de manipular la microbiota intestinal existente como herramienta preventiva o terapéutica en la alergia alimentaria. Sin embargo, a día de hoy no existe evidencia científica suficiente que avale el empleo de estas terapias microbianas para prevenir o tratar la alergia alimentaria aunque sin duda es un campo prometedor en el que seguir trabajando.
Para ampliar: video en youtube de la Dra. Venter sobre el papel de la microbiota en la alergia alimentaria: (2023) Youtube.com: https://www.youtube.com/watch?v=IpZXU-iKF9A (Accessed: 14 February 2023).
Dra. Isabel Fernández de Alba Porcel, Hospital HLA Inmaculada, Granada. Comité de Alergia Infantil
Bibliografía
- Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, Mandhane PJ, Turvey SE, Subbarao P, Becker AB, Scott JA, Kozyrskyj AL; CHILD Study Investigators. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy. 2015 Mar;45(3):632-43. doi: 10.1111/cea.12487. PMID: 25599982.
- Bager P, Wohlfahrt J, Westergaard T. Caesarean delivery and risk of atopy and allergic disease: meta-analyses. Clin Exp Allergy. 2008 Apr;38(4):634-42. doi: 10.1111/j.1365-2222.2008.02939.x. Epub 2008 Feb 11. PMID: 18266879.
- Bunyavanich S, Berin MC. Food allergy and the microbiome: Current understandings and future directions. J Allergy Clin Immunol. 2019 Dec;144(6):1468-1477
- Bunyavanich S, Shen N, Grishin A, Wood R, Burks W, Dawson P, Jones SM, Leung DYM, Sampson H, Sicherer S, Clemente JC. Early-life gut microbiome composition and milk allergy resolution. J Allergy Clin Immunol. 2016 Oct;138(4):1122-1130. doi: 10.1016/j.jaci.2016.03.041. Epub 2016 May 10. PMID: 27292825; PMCID: PMC5056801.
- Fazlollahi M, Chun Y, Grishin A, Wood RA, Burks AW, Dawson P, Jones SM, Leung DYM, Sampson HA, Sicherer SH, Bunyavanich S. Early-life gut microbiome and egg allergy. Allergy. 2018 Jul;73(7):1515-1524. doi: 10.1111/all.13389. Epub 2018 Mar 15. PMID: 29318631; PMCID: PMC6436531.
- Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, Arshad H, Bahnson HT, Beyer K, Boyle R, du Toit G, Ebisawa M, Eigenmann P, Grimshaw K, Hoest A, Jones C, Lack G, Nadeau K, O’Mahony L, Szajewska H, Venter C, Verhasselt V, Wong GWK, Roberts G; European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021 Jul;32(5):843-858. doi: 10.1111/pai.13496. Epub 2021 Mar 29. PMID: 33710678.
- Jungles KN, Jungles KM, Greenfield L, Mahdavinia M. The Infant Microbiome and Its Impact on Development of Food Allergy. Immunol Allergy Clin North Am. 2021 May;41(2):285-299.
- Koplin JJ, Dharmage SC, Ponsonby AL, Tang ML, Lowe AJ, Gurrin LC, Osborne NJ, Martin PE, Robinson MN, Wake M, Hill DJ, Allen KJ; HealthNuts Investigators. Environmental and demographic risk factors for egg allergy in a population-based study of infants. Allergy. 2012 Nov;67(11):1415-22. doi: 10.1111/all.12015. Epub 2012 Sep 7. PMID: 22957661.
- Noval Rivas M, Burton OT, Wise P, Zhang YQ, Hobson SA, Garcia Lloret M, Chehoud C, Kuczynski J, DeSantis T, Warrington J, Hyde ER, Petrosino JF, Gerber GK, Bry L, Oettgen HC, Mazmanian SK, Chatila TA. A microbiota signature associated with experimental food allergy promotes allergic sensitization and anaphylaxis. J Allergy Clin Immunol.2013 Jan;131(1):201-12. doi: 10.1016/j.jaci.2012.10.026. Epub 2012 Nov 30. PMID: 23201093; PMCID: PMC3860814.
- Otero, Olalla (2022) El revolucionario mundo de los probióticos: Qué son, cómo funcionan y para qué sirven. Barcelona, Alienta editorial.
- Rachid R, Stephen-Victor E, Chatila TA. The microbial origins of food allergy. J Allergy Clin Immunol. 2021Mar;147(3):808-813. doi: 10.1016/j.jaci.2020.12.624. Epub 2020 Dec 22. PMID: 33347905; PMCID: PMC8096615.
- Savage JH, Lee-Sarwar KA, Sordillo J, Bunyavanich S, Zhou Y, O’Connor G, Sandel M, Bacharier LB, Zeiger R, Sodergren E, Weinstock GM, Gold DR, Weiss ST, Litonjua AA. A prospective microbiome-wide association study of food sensitization and food allergy in early childhood. Allergy. 2018 Jan;73(1):145-152. doi: 10.1111/all.13232. Epub 2017 Aug 2. PMID: 28632934; PMCID: PMC5921051.
Nuevos alimentos, viejos alérgenos
Los insectos forman parte de la cocina de muchos países del mundo y su consumo dentro de Europa va avanzando en últimos años. Aproximadamente dos mil millones de personas en todo el mundo consumen insectos especialmente en países como Asia, América Latina y África1.
El consumo de insectos es en la actualidad una tendencia alimentaria en auge. Desde el 1 de enero de 2018 la legislación europea cataloga a los insectos como “nuevo alimento” y según la Organización para la Agricultura y la Alimentación de las Naciones Unidas (FAO), les considera “el alimento del futuro”.
Hoy en día, son cuatro los insectos autorizados en el mercado europeo: las larvas del gusano de la harina (en forma congelada, desecada y en polvo), la langosta migratoria (en forma congelada, desecada y en polvo), el grillo doméstico (en forma congelada, desecada, en polvo y polvo parcialmente desgrasado) y las larvas del escarabajo del estiércol (en forma congelada, en pasta, desecada y en polvo) 2. Aunque a nivel general este habito de consumo no está muy extendido, en nuestra dieta, consumimos de forma inadvertida el componente “E12” o carmín, una sustancia que se obtiene del insecto cochinilla, que se utiliza para teñir diversos alimentos de confiterías, pasteles y mermeladas, jarabes, yogures, bebidas y carnes.
Además, hay ocho solicitudes pendientes para insectos destinados a ser comercializados en diferentes formas que actualmente están siendo objeto de una evaluación de seguridad2.
Los insectos representan una alternativa a la carne y el pescado para satisfacer la creciente demanda de fuentes sostenibles de nutrición 1.
Desde el punto de vista nutricional, los estudios científicos avalan que los insectos son una fuente de nutrientes muy saludables con alto contenido en proteínas, vitaminas B1, B2 y B3, contienen omega 3 y 6, todos los aminoácidos esenciales y son una fuente importante de minerales como el hierro.
Hay otro factor que debe tenerse en cuenta y que juega a favor del consumo de insectos: el impacto medioambiental. La producción de proteína de insectos supone una importante reducción de gases de efecto invernadero y supone una menor contaminación respecto a otras proteínas de origen animal.
Respecto a la seguridad de su consumo, la Comisión Europea con el reglamento sobre nuevos alimentos, asegura que se disponga de la información alimentaria obligatoria para que sean seguros para los consumidores y estén debidamente etiquetados, incluyendo la identificación correcta de alérgenos.
Al igual que las proteínas de otros alimentos, las contenidas en los insectos, son susceptibles de desencadenar reacciones alérgicas graves. Cada vez son más los pacientes que llegan a nuestras consultas por reacciones alérgicas, incluyendo reacciones anafilácticas, tras la ingestión de insectos.
Se han identificado varios alérgenos implicados en la alergia a insectos, entre ellos la tropomiosina y la arginina quinasa, ambos panalérgenos conocidos por su reactividad cruzada con proteínas homólogas en crustáceos y ácaros del polvo doméstico. Se ha demostrado reactividad cruzada y/o cosensibilización de la tropomiosina de insectos y la arginina quinasa en pacientes alérgicos a los ácaros del polvo doméstico y a los mariscos (p. ej., langostinos, gambas). También se ha demostrado que el procesamiento térmico y la digestión no eliminaron la alergenicidad de las proteínas de insectos1.
Algunos estudios señalan que la proteína de la cutícula de la larva del gusano, podría ser un alérgeno importante en la sensibilización primaria al gusano de la harina. Otros alérgenos, como la actina,insectoo la cadena ligera similar a la miosina, también se identifican como factor de riesgo de reactividad cruzada entre crustáceos y gusanos de la harina 3.
La disponibilidad de este tipo de alimentos en supermercados y su venta on-line, esta haciendo que cada vez su consumo sea más frecuente.
Es importante el papel que juega el alergólogo en este momento en el que el consumo de insectos empieza a instaurarse poco a poco en nuestra dieta para poder asesorar adecuadamente a los pacientes.
Rocío Candón Morillo. Hospital Universitario de Jerez. Comité de Alergia Infantil SEAIC.
Bibliografía
1.-Insect (food) allergy and allergens. Steffie de Gier , Kitty Verhoeckx .Molecular Immunology. Volume 100, August 2018, Pages 82-106
2.- Los insectos como nuevos alimentos: claves para asesorar adecuadamente a la población sobre su consumo. Diario medico.
3.-Mankouri F1, Sereme Y2,3, Michel M2,3, Piarroux R4, Pahus , Chanez P1,6, Vitte J2,3, Gouitaa MJ Investig . Immediate Hypersensitivity to Mealworm and Cricket: Beyond Shrimp and House Dust Mite
Cross-Reactivity. Allergol Clin Immunol 2022; Vol. 32(1): 56-78
Telealergia: ¿vino para quedarse?
Artículo: Teleallergy: Where Have We Been and Where Are We Going? Ramsey A, Chen Wu A, Bender B, Portnoy J. J Allergy Clin Immunol Pract 2023;11:126-31.
La telemedicina se puede definir, como el uso de las tecnologías de la información, por medio de los sistemas telemáticos, para proporcionar asistencia médica, independientemente de la distancia que separa al paciente del profesional médico.
Los primeros datos de telemedicina aplicados al campo de la Alergología son muy escasos a partir de los años 90. Sin embargo, el uso de la telemedicina se incrementa de forma exponencial a partir del año 2020. Este año, queda marcado en la historia por la extensión de la enfermedad provocada por el virus SARS-CoV-2019 (COVID-19), lo que condicionó un cierre de la actividad socioeconómica mundial casi global. Tras declararse la pandemia por la Organización Mundial de la Salud en marzo de 2020, el gobierno español decretó el estado de alarma con el consiguiente confinamiento domiciliario, que se prolongó hasta junio de 2020. Posteriormente se han sucedido diversas olas pandémicas que han ido afectando de forma diversa la asistencia médica.
El modelo de acceso y prestación de la asistencia sanitaria cambió bruscamente, primero en la Atención Primaria, y posteriormente en las diferentes especialidades médicas. El patrón clásico de asistencia presencial, ha sido sustituido por un patrón mixto, en el que las herramientas de telemedicina han desempeñado un papel determinante. Centrándonos en el campo de la Alergología, investigadores norteamericanos dirigidos por Ramsey y cols., han llevado a cabo una revisión sobre el impacto de la telemedicina en la satisfacción de los pacientes alérgicos, en el coste de la asistencia, así como en el entorno normativo que debe regular en el futuro la telemedicina.
1.- Satisfacción del paciente
- Satisfacción del paciente antes de la epidemia COVID:
Hay diversos estudios en los primeros años del siglo XXI. Así, en 2015, Portnoy y cols., compararon las visitas presenciales frente a la teleasistencia, en 169 pacientes pediátricos con asma bronquial. El 90% de los pacientes consideraban satisfactoria la asistencia sanitaria, y un 88% la recomendaría para las revisiones médicas.
- Satisfacción durante la epidemia COVID:
Diversos estudios muestran una opinión favorable. En el estudio de Mustafa y cols., con 251 pacientes alérgicos, la satisfacción fue general para todos los tipos de enfermedades alérgicas, salvo en la alergia a alimentos, donde los pacientes consideraron óptima la visita presencial. En otro estudio dirigido por Emory con 269 pacientes, la satisfacción fue plena con la consulta telemática para el 79% de los pacientes, siendo el dato mas relevante la facilidad para poder asistir a la cita. No obstante, incluso con datos satisfactorios, los investigadores refieren que determinados procedimientos en el campo de la Alergología, como la realización de las pruebas cutáneas o los estudios de pruebas de tolerancia con alimentos o medicamentos requieren de la visita presencial. Otros estudios, sin embargo, muestran una mayor satisfacción con las visitas presenciales, especialmente en pacientes con dermatitis atópica, múltiples alergias a alimentos o pacientes pediátricos con asma bronquial.
2.- Satisfacción del médico
Tradicionalmente los alergólogos no han utilizado la telemedicina, por lo que se les deben facilitar herramientas que permitan su uso. Sin embargo, salvo en algunos países, no se han desarrollado programas de formación para los especialistas ni tampoco la asistencia mediante aplicaciones informáticas.
La principal ventaja de utilizar la telemedicina en la práctica clínica habitual es el ahorro de tiempo que supone para el médico disminuir las horas de consulta dedicadas a labores burocráticas. Este tiempo podría reinvertirse en reducir las listas de espera dedicadas a dar resultados analíticos, resolver dudas a pacientes a cerca de tratamientos de una forma más rápida, así como conseguir una comunicación más fluida con pacientes y médicos de Atención Primaria. De esta manera, se agilizarían procedimientos ordinarios y mejoraría la calidad asistencial del paciente.
3.- Coste socioeconómico de la telemedicina
Por un lado, la telemedicina puede reducir los costes de las enfermedades alérgicas ya que disminuye los gastos en el transporte hasta la consulta médica, así como el absentismo escolar y laboral. Sin embargo, tiene otras desventajas que pueden incrementar el coste como es la falta de acceso directo al profesional sanitario y su supervisión, lo que puede implicar una peor evolución clínica de la enfermedad. Existen pocos estudios durante la pandemia Covid de telemedicina y coste sanitario. En un estudio sobre pacientes pediátricos diagnosticados de asma bronquial, se observó que tras realizar un programa de telemedicina en el primer año de la pandemia Covid, hubo una reducción en las reagudizaciones asmáticas. Este hecho puede ser atribuible no a la telemedicina en si misma, sino a la escolarización en casa durante los primeros meses Covid, así como el uso de la mascarilla, ya que ambas situaciones redujeron la exposición a diferentes virus durante ese periodo de tiempo, lo que puede explicar la reducción en las exacerbaciones asmáticas. Por otro lado, es conocido que la telealergia tiene su mayor potencial de mejora del gasto sanitario en las zonas rurales o áreas que no disponen de alergólogo cercano, por lo que requieren un desplazamiento importante para la asistencia médica. Así, en un estudio alemán hecho con 112 pacientes con rinitis alérgica, la telemedicina generó un ahorro de 60.000 euros por año y redujo en 2.3 los días perdidos de trabajo o escuela, por paciente y año.
4.- Cambios en el marco regulatorio
La introducción y el uso progresivo de la telemedicina aplicado al campo de la Alergología, debe acompañarse de una actualización en el marco legislativo, así como de la cobertura y coste de los seguros de asistencia médica, tanto en la Sanidad Privada como Pública, que deben ir acometiéndose durante los próximos años.
CONCLUSIONES
Tras la pandemia Covid, la telemedicina aplicada al campo de la Alergología es una realidad. Esta herramienta ofrece ventajas, las principales, la reducción de absentismo laboral/escolar y transporte, la mejor adherencia en el seguimiento y la mayor agilidad en las revisiones médicas. Ofrece también una posible mejoría en la educación continuada del paciente alérgico con las diferentes herramientas informáticas, así como en el seguimiento del cumplimiento terapéutico. Sin embargo, pese a estas ventajas, la asistencia presencial seguirá siendo vital en nuestra especialidad, para la realización de muchos de nuestros procedimientos diagnósticos y terapéuticos, así como para aquellos pacientes que requieran un diagnóstico inicial, una valoración directa por parte del alergólogo o cuando la gravedad o el control de la enfermedad así lo requiera.
Marta Reche. Servicio de Alergología. Hospital Universitario Infanta Sofía. San Sebastián de los Reyes. Madrid. Comité de Alergia Infantil
Alergia al veneno de himenópteros en niños
La picadura de insectos en la población pediátrica es una causa frecuente de búsqueda de asistencia médica en época estival. La alergia al veneno de los himenópteros es una reacción del sistema inmunitario frente al veneno tras la picadura de éstos.
Las picaduras de himenópteros, principalmente de abejas y avispas, son los principales responsables de las reacciones alérgicas tras picadura de insectos en nuestro medio. Según la Guía Alergia al Veneno de los Himenópteros de la EAACI (Academia Europea de Alergia e Inmunología Clínica) las reacciones alérgicas sistémicas a picaduras de estos insectos afectan al 3,4% de los niños. La alergia a su veneno suele aparecer a partir de una segunda picadura, que es cuando el menor habrá quedado sensibilizado a su veneno, por lo que es más frecuente en niños mayores.
Las reacciones que suelen producirse son de dos tipos:
– Locales cuando aparece enrojecimiento, hinchazón y dolor en la zona y puede afectar hasta a dos articulaciones. El tratamiento es la limpieza de la zona con agua y jabón, se puede aplicar amoniaco y frío local, además de antihistamínicos y corticoides orales.
– Sistémicas o generalizadas cuando los síntomas afectan a otras partes del cuerpo, suelen aparecer lesiones habonosas y mucho picor, inflamación en los ojos y la boca, síntomas respiratorios, dificultad para tragar, mareo, bajada de tensión e incluso pérdida de conocimiento. Estaríamos ante una anafilaxia que puede ser peligrosa para la vida si no se trata a tiempo. Por ello hay que administrar de forma rápida adrenalina intramuscular, además de corticoides y antihistamínicos orales y se debe acudir de inmediato a urgencias para una valoración por el equipo médico y completar el tratamiento si fuera necesario.
La alergia al veneno de avispa o de abeja puede diagnosticarse mediante una prueba de punción cutánea y/o con una analítica en sangre de anticuerpos en suero (IgE).
Una vez diagnosticada la alergia a veneno de himenópteros y con antecedentes de reacción anafiláctica, la vacuna con veneno es el único tratamiento existente para prevenir futuros episodios y evitar las reacciones. Además, goza de muy buena reputación entre los pacientes pues claramente mejora su calidad de vida.
Los riesgos de reacción alérgica a picaduras de himenópteros en niños diagnosticados de alergia a su veneno, se incrementan durante los meses de verano debido al mayor tiempo que pasan al aire libre. El campo, la piscina y todos aquellos lugares con mucha vegetación o aguas estancadas son el ambiente ideal para este tipo de insectos.
Para evitar que estas picaduras se produzcan, sobre todo durante el verano, lo aconsejable es evitar en la medida de lo posible la proximidad a los nidos de avispas o abejas. Además, es recomendable que el niño no ande descalzo por el césped, sacudir la ropa antes de ponérsela, comprobar que los asientos, vasos u otros utensilios están limpios de insectos, evitar que lleven ropas llamativas o colonias y cremas muy perfumadas en el campo o tener los cubos de basura bien cerrados en lugares con vegetación.
Dra. Paula Méndez Brea. Médico adjunto del Servicio de Alergología. Complexo hospitalario universitario De Santiago de Compostela. Comité de Alergia Infantil SEAIC
Bibliografía:
Tankersley M, Ledford D. Stinging Insect Allergy: State of the Art 2015. J Allergy Clin Immunol Pract 2015;3(3):315-22.
Krishna M, Ewan P, Diwakar L, et al. Diagnosis and management of hymenoptera venom allergy: British Society for Allergy and Clinical Immunology (BSACI) guidelines. Clin Exp Allergy 2011;41(9):1201-20.
Karabus S. Hypersensitivity to stinging insects. Curr Allergy Clin Im 2012;25(3):132-8.
Nevot Falcó S, Ferré Ybarz L. Hipersensibilidad a veneno de himenópteros. Protoc Diagn Ter Pediatr 2013;1:135-44.
Lange J, Cichocka-Jarosz E, Marczak H, et al. Natural history of Hymenoptera venom allergy in children not treated with immunotherapy. Ann Allergy Asthma Immunol 2016;116(3):225-9.
Bilo MB, Bonifazi F. The natural history and epidemiology of insect venom allergy: Clinical implications. Clin Exp Allergy. 2009;39(10):1467-76.
Sturm GJ, Varga E-M, Roberts G, et al. EAACI guidelines on allergen immunotherapy: Hymenoptera venom allergy. Allergy. 2017;00:1–20.
Sturm GJ el al. EAACI guidelines on allergen immunotherapy: Hymenopteravenom allergy. Allergy . 2018;73(4):744-764.
Actualización en Anafilaxia (guía GALAXIA)
Recientemente, se ha presentado en el Congreso de la Sociedad Española de Alergología e Inmunología Clínica, la tercera actualización de la Guía Galaxia, un documento de posicionamiento sobre el diagnóstico y el tratamiento de la anafilaxia, en esta edición se presentan novedades relevantes como la perspectiva del paciente y la implicación de la sociedad para la creación de ambientes seguros.
La anafilaxia es la presentación clínica aguda más grave de una reacción alérgica y puede comprometer la vida del paciente, es una emergencia médica que requiere de una actuación inmediata, con el reconocimiento de la clínica y un tratamiento precoz, y de un manejo a medio y, largo plazo que incluya medidas de educación y prevención, en algunos casos se puede conseguir la curación, como la anafilaxia por veneno de himenópteros, o en algunas alergias alimentarias
Todo paciente que ha sufrido una anafilaxia debe ser derivado a un especialista de Alergología para realizar un estudio completo, confirmar el desencadenante sospechoso, prevenir nuevos episodios, evaluando la posibilidad del paciente de volver a desarrollarlos y recibir información, y un tratamiento adecuado.
El paciente diagnosticado de anafilaxia debe ser valorado por el especialista
por lo menos una vez al año, y en esa consulta se le debe explicar y dar por escrito:
- Normas estrictas de evitación de los alérgenos (sustancias que provoca la reacción alérgica) implicados o sospechosos que incluyan los alergenos específicos y su reactividad cruzada con otros productos, esta información debe ser revisada en cada visita
- Educación para el reconocimiento precoz de los síntomas típicos de la anafilaxia incluyendo un plan de actuación que indique al paciente que tratamiento administrar dependiendo de la clínica que presente en el momento de la reacción, y que le permita una actuación lo más rápida posible, para evitar un desenlace fatal
- Educación y entrenamiento sobre el uso de autoinyectores de adrenalina. En los siguientes casos es necesario llevar dos dispositivos: si hay coexistencia de asma inestable o moderada-grave persistente y alergia a alimentos, si hay coexistencia de enfermedad mastocitaria y/o triptasa basal elevada, falta de acceso rápido a asistencia sanitaria por barreas geográficas o idiomáticas, requerimiento previo de más de una dosis antes de llegar a un hospital, reacción previa casi mortal, dosis del autoinyector inferior a la calculada por peso del paciente. Se deben administrar de forma precoz.
Existe un uso deficiente de los autoinyectores, por escasa información, miedo o aversión al tratamiento intramuscular, dificultades económicas o afectación en la calidad de vida por la dificultad de llevarlo consigo. Los padres, tutores y docentes deben estar entrenados en su uso en el caso de los niños. El alergólogo debe informar de que la adrenalina tiene una vida útil corta, por lo que se debe revisar la fecha de caducidad y la reposición de los dispositivos caducados
- Recibir información sobre las enfermedades o tratamientos (comorbilidades) que pueden provocar una sintomatología más grave, o disminuir la atención del paciente ante los síntomas. El asma mal controlada, las enfermedades cardiovasculares, algunos fármacos como los betabloqueantes, los IECA (inhibidores del enzima convertidor de la angiotensina), ansiolíticos, pueden aumentar el riesgo de desarrollar una anafilaxia fatal
- Medidas de prevención: Tratamientos que pueden curar o mitigar la sensibilización a alérgenos específicos, como la inmunoterapia oral con alimentos en casos seleccionados, desensibilización a fármacos, o inmunoterapia con venenos de himenópteros. Llevar una pulsera o tarjeta de identificación médica en la cartera, recomendar llevar teléfono móvil si el paciente está solo
También es labor de los especialistas, pacientes, y asociaciones de pacientes impulsar medidas de salud pública, como exigir la mejora del etiquetado de los alimentos, exigir planes de acción en colegios, restaurantes ( información disponible y accesible para los ingredientes del alimento no envasado) y centros de ocio ( recomendar espacios alergoprotegidos que dispongan de lo necesario para asistir a una persona que sufra un episodio de anafilaxia ) e intentar conseguir que en edificios públicos, centros de ocio , y comerciales se disponga de autoinyectores de adrenalina, como ahora se dispone de desfibriladores.
Se aconseja al lector visualizar los siguientes videos sobre
Auto inyectores de adrenalina:
Anapen: https://youtu.be/8I-r_ftcUMc
Jext:: https://youtu.be/QDXRhZBNjFw
Altellus: https://www.epinefrina.es/es-es/epinefrinaguide?userstate=public#
Emerade: https://youtu.be/NzyNoUeiu9o
Dra. M.ª Isabel Alvarado Izquierdo. Alergóloga del Complejo Hospitalario Universitario de Cáceres. Miembro del Comité de Alergia Infantil de la SEAIC